Таллий
Большая Советская Энциклопедия. Статьи для написания рефератов, курсовых работ, научные статьи, биографии, очерки, аннотации, описания.
|
|
| ТАА |
| ТАБ |
| ТАВ |
| ТАГ |
| ТАД |
| ТАЁ |
| ТАЖ |
| ТАЗ |
| ТАИ |
| ТАЙ |
| ТАК |
| ТАЛ |
| ТАМ |
| ТАН |
| ТАО |
| ТАП |
| ТАР |
| ТАС |
| ТАТ |
| ТАУ |
| ТАФ |
| ТАХ |
| ТАЦ |
| ТАЧ |
| ТАШ |
| ТАЯ |
Таллий (лат. Thallium), Tl, химический элемент III группы периодической системы Менделеева, атомный номер 81, атомная масса 204,37; на свежем разрезе серый блестящий металл; относится к редким рассеянным элементам. В природе элемент представлен двумя стабильными изотопами 203Tl (29,5%) и 205Tl (70,5%) и радиоактивными изотопами 207Tl—210Tl — членами радиоактивных рядов. Искусственно получены радиоактивные изотопы 202Tl (T1/2 = 12,5 сут),204Tl (T1/2 = 4,26 года) и 206Tl (T1/2 = 4,19 мин). Таллий открыт в 1861 У. Круксом в шламе сернокислотного производства спектроскопическим методом по характерной зелёной линии в спектре (отсюда название: от греч. thallós — молодая, зелёная ветка). В 1862 французский химик К. О. Лами впервые выделил Таллий и установил его металлическую природу.
Распространение в природе. Среднее содержание Таллий в земной коре (кларк) 4,5×10-5% по массе, но благодаря крайнему рассеянию его роль в природных процессах невелика. В природе встречаются преимущественно соединения одновалентного и реже трёхвалентного Таллий Как и щелочные металлы, Таллий концентрируется в верхней части земной коры — в гранитном слое (среднее содержание 1,5×10–4%), в основных породах его меньше (2×10–5%), а в ультраосновных лишь 1×10–6%. Известно лишь семь минералов Таллий (например, круксит, лорандит, врбаит и др.), все они крайне редкие. Наибольшее геохимическое сходство Таллий имеет с К, Rb, Cs, а также с Pb, Ag, Cu, Bi (см. Рассеянные элементы, Рассеянных элементов руды). Таллий легко мигрирует в биосфере. Из природных вод он сорбируется углями, глинами, гидроокислами марганца, накапливается при испарении воды (например, в озере Сиваш до 5×10–8 г/л).
Физические и химические свойства. Таллий мягкий металл, на воздухе легко окисляется и быстро тускнеет. Таллий при давлении 0,1 Мн/м2 (1 кгс/см2) и температуре ниже 233 °С имеет гексагональную плотноупакованную решётку (а = 3,4496 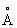 ; с = 5,5137
; с = 5,5137 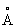 ), выше 233 °С — объёмноцентрированную кубическую (а = 4,841
), выше 233 °С — объёмноцентрированную кубическую (а = 4,841 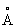 ), при высоких давлениях 3,9 Гн/м2 (39000 кгс/см2) — гранецентрированную кубическую; плотность 11,85г/см3; атомный радиус 1,71
), при высоких давлениях 3,9 Гн/м2 (39000 кгс/см2) — гранецентрированную кубическую; плотность 11,85г/см3; атомный радиус 1,71 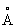 , ионные радиусы: Tl+ 1,49
, ионные радиусы: Tl+ 1,49 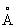 , Tl3+ 1,05
, Tl3+ 1,05 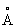 ; tпл 303,6 °С; tкип 1457 °С, удельная теплоёмкость 0,130 кджl (кг×K) [0,031 кал/г×С)} при 20—100 °С; температурный коэффициент линейного расширения 28×10–6 при 20 °С и 41,5×10–6 при 240—280 °С; теплопроводность 38,94 вт/(м×К) [0,093 кал/(см ×сек × °С)]. Удельное электросопротивление при 0°С (18×10–6ом ×см); температурный коэффициент электросопротивления 5,177×10–3 — 3,98 ×10–3 (0—100 °С). Температура перехода в сверхпроводящее состояние 2,39 К. Таллий диамагнитен, его удельная магнитная восприимчивость —0,249×10–6 (30 °С).
; tпл 303,6 °С; tкип 1457 °С, удельная теплоёмкость 0,130 кджl (кг×K) [0,031 кал/г×С)} при 20—100 °С; температурный коэффициент линейного расширения 28×10–6 при 20 °С и 41,5×10–6 при 240—280 °С; теплопроводность 38,94 вт/(м×К) [0,093 кал/(см ×сек × °С)]. Удельное электросопротивление при 0°С (18×10–6ом ×см); температурный коэффициент электросопротивления 5,177×10–3 — 3,98 ×10–3 (0—100 °С). Температура перехода в сверхпроводящее состояние 2,39 К. Таллий диамагнитен, его удельная магнитная восприимчивость —0,249×10–6 (30 °С).
Конфигурация внешней электронной оболочки атома Tl 6s26p1; в соединениях имеет степень окисления +1 [Tl (I)] и + 3 [Tl (III)]. Таллий взаимодействует с кислородом и галогенами уже при комнатной температуре, с серой и фосфором при нагревании. Хорошо растворяется в азотной, хуже в серной кислотах, не растворяется в галогенводородных, муравьиной, щавелевой и уксусной кислотах. Не взаимодействует с растворами щелочей; свежеперегнанная вода, не содержащая кислорода, не действует на Таллий Основные соединения с кислородом: закись Tl2O и окись Tl2O3.
Закись Таллий и соли Tl (I) нитрат, сульфат, карбонат — растворимы; хромат, бихромат, галогениды (за исключением фторида), а также окись Таллий — малорастворимы в воде. Tl (III) образует большое число комплексных соединений с неорганическими и органическими лигандами. Галогениды Tl (III) хорошо растворимы в воде. Наибольшее практическое значение имеют соединения Tl (I).
Получение. В промышленных масштабах технический Таллий получают попутно при переработке сульфидных руд цветных металлов и железа. Его извлекают из полупродуктов свинцового, цинкового и медного производств. Выбор способа переработки сырья зависит от его состава. Например, для извлечения Таллий и др. ценных компонентов из пылей свинцового производства проводится сульфатизация материала в кипящем слое при 300—350 °С. Полученную сульфатную массу выщелачивают водой, и из раствора экстрагируют Таллий 50%-ным раствором трибутилфосфата в керосине, содержащим йод, а затем реэкстрагируют серной кислотой (300 г/л) с добавкой 3%-ной перекиси водорода. Из реэкстрактов металл выделяют цементацией на цинковых листах. После переплавки под слоем едкого натра получают Таллий чистотой 99,99%. Для более глубокой очистки металла применяют электролитические рафинирование и кристаллизационную очистку.
Применение. В технике Таллий применяется, главным образом, в виде соединений. Монокристаллы твёрдых растворов галогенидов TIBr — TlI и TlCl — TlBr (известные в технике как КРС-5 и КРС-6) используют для изготовления оптических деталей в приборах инфракрасной техники; кристаллы TlCl и TlCl—TlBr — в качестве радиаторов счётчиков Черенкова. Tl2O входит в состав некоторых оптических стекол; сульфиды, оксисульфиды, селениды, теллуриды — компоненты полупроводниковых материалов, использующихся при изготовлении фотосопротивлений, полупроводниковых выпрямителей, видиконов. Водный раствор смеси муравьинои малоновокислого Таллий (тяжёлая жидкость Клеричи) широко применяют для разделения минералов по плотности. Амальгама Таллий, затвердевающая при –59 °С, применяется в низкотемпературных термометрах. Металлический Таллий используют для получения подшипниковых и легкоплавких сплавов, а также в кислородомерах для определения кислорода в воде. 204Tl в качестве источника b-излучении применяют в радиоизотопных приборах.
Таллий И. Дарвойд.
Таллий в организме. Таллий постоянно присутствует в тканях растений и животных. В почвах его среднее содержание составляет 10–5%, в морской воде 10–9%, в организмах животных 4×10–5%. У млекопитающих Таллий хорошо всасывается из желудочно-кишечного тракта, накапливаясь главным образом в селезёнке и мышцах. У человека ежесуточное поступление Таллий с продуктами питания и водой составляет около 1,6 мкг, с воздухом — 0,05 мкг. Биологическая роль Таллий в организме не выяснена. Умеренно токсичен для растений и высоко токсичен для млекопитающих и человека.
Отравления Таллий и его соединениями возможны при их получении и практическом использовании. Таллий проникает в организм через органы дыхания, неповрежденную кожу и пищеварительный тракт. Выводится из организма в течение длительного времени, преимущественно с мочой и калом. Острые, подострые и хронические отравления имеют сходную клиническую картину, различаясь выраженностью и быстротой возникновения симптомов. В острых случаях через 1—2 сут появляются признаки поражения желудочно-кишечного тракта (тошнота, рвота, боли в животе, понос, запор) и дыхательных путей. Через 2—3 нед наблюдаются выпадение волос, явления авитаминоза (сглаживание слизистой оболочки языка, трещины в углах рта и т. д.). В тяжёлых случаях могут развиться полиневриты, психические расстройства, поражения зрения и др. Профилактика профессиональных отравлений: механизация производственных процессов, герметизация оборудования, вентиляция, использование средств индивидуальной защиты.
Л. П. Шабалика.
Лит.: Химия и технология редких и рассеянных элементов, под ред. К. А. Большакова, т. 1, [М., 1965]; 3еликман А. Н., Меерсон Г. А., Металлургия редких металлов, М., 1973; Таллий и его применение в современной технике, М., 1968; Тихова Г. С., Дарвойд Таллий И., Рекомендации по промышленной санитарии и технике безопасности при работе с таллием и его соединениями, в сборнике: Редкие металлы, в. 2, М., 1964; Воwen Н. Y. М., Trace elements in biochemistry, L.—N. Y., 1966.
Израэльсон З. И., Могилевская О. Я., Суворове. В. Вопросы гигиены труда и профессиональной патологии при работе с редкими металлами, М., 1973.
|
Так же Вы можете узнать о... Тедиашвили Леван Китоевич (р. 15.3.1948, с. Гегмоубани Сагареджойского района Грузинской ССР), советский спортсмен, заслуженный мастер спорта (1971), преподаватель. Трир Герсон Трир (Trier) Герсон (23.4.1851, Копенгаген, — 22. Уэльс (адм.-политич. часть Великобритании) Уэльс, Узле (Wales), административно-политическая часть Великобритании. Фунгицидные антибиотики, группа антибиотиков, обладающих противогрибковым действием. Центурия (лат. centuria, от centum — сто), в Древнем Риме единица военно-политического деления граждан. Шебекино, город (с 1938) областного подчинения, центр Шебекинского района Белгородской области РСФСР. Эллиптические галактики, гигантские звёздные системы, имеющие форму эллипсоида. Августовское наступление 1919, наступление советских войск Южного фронта (на 15 июля около 160 тыс. Амфодонтоз (от греч. amphi — вокруг и odús, родительный падеж odontos — зуб), заболевание, выражающееся в рассасывании зубных луночек, то же, что пародонтоз. Афронт (франц. affront — оскорбление, позор) (устар. Бергандер Рудольф Бергандер (Bergander) Рудольф (22.5.1909, Мейсен, — 10. |
|