Электросинтез
Большая Советская Энциклопедия. Статьи для написания рефератов, курсовых работ, научные статьи, биографии, очерки, аннотации, описания.
|
|
| ЭЛА |
| ЭЛВ |
| ЭЛГ |
| ЭЛД |
| ЭЛЕ |
| ЭЛИ |
| ЭЛК |
| ЭЛЛ |
| ЭЛМ |
| ЭЛО |
| ЭЛП |
| ЭЛС |
| ЭЛУ |
| ЭЛЬ |
| ЭЛЮ |
| ЭЛЯ |
Электросинтез (от электро... и синтез), метод получения сложных неорганических или органических соединений с помощью электролиза. Характерная особенность Электросинтез — многостадийность присоединения или отдачи электронов, связанная с образованием промежуточных стабильных или нестабильных продуктов. Каждой стадии Электросинтез соответствует определённое значение электродного потенциала.
Многостадийные процессы Электросинтез могут быть выражены с помощью следующих уравнений:
R + nH++ ne—® RHk + (n — k) Н+ + (n —k) e—® RHk+r + (n—k— r) Н+ + (n —k — r) е— ® RHn, (1)
R' + nOH— — ne—® R'Ok + (n — k) OH— + kH++ (n — k) е—® R'Ok+r + (n — k — r) OH-+ (k + r) H+ — (n — k — r) e— ® R'On + nH+, (2)
где R и R' — исходные продукты; RHn и R'On — конечные продукты; n, k, r — число электронов (е—), участвующих в электрохимических реакциях.
Реакции, выражаемые уравнением (1), протекают на катоде и называются реакциями электровосстановления, или электрохимического восстановления. Реакции, выражаемые уравнением (2), протекают на аноде и называются реакциями электроокисления, или электрохимического окисления. Промежуточные и конечные продукты могут принимать участие в различных электрохимических реакциях на поверхности электродов.
Если целевой продукт Электросинтез образуется на промежуточной стадии, то электролиз необходимо проводить при контролируемом электродном потенциале, соответствующем данной стадии. Продукт можно быстро выводить из сферы реакции путём отгонки, экстракции или связывания в соединение, не вступающее в электрохимические превращения. Выход продукта Электросинтез может изменяться и в результате различных химических реакций в объёме раствора с участием промежуточных, исходных и конечных веществ. Например, некоторые окислители, получаемые на аноде, могут разлагаться в объёме раствора с потерей активного кислорода, гидролизоваться, диспропорционировать и т. д. Роль химических реакций в объёме раствора учитывается по объёмной плотности тока, или концентрации тока. Эта величина определяется как сила тока, проходящего через единицу объёма электролита, и выражается в а/л. Процессы Электросинтез, в которых химические реакции в объёме раствора приводят к уменьшению выхода целевого продукта, должны проводиться с высокими объёмными плотностями тока (до нескольких сотен а/л).
С наибольшей эффективностью электровосстанавливаются или электроокисляются исходные вещества, диссоциированные в растворе на ионы, а также органические соединения, имеющие полярные функциональные группы. Нейтральные молекулы органических веществ во многих случаях не обладают достаточной реакционной способностью и не вступают в реакции на поверхности электрода. В этом случае применяются методы непрямого электровосстановления или электроокисления, осуществляемые в объёме раствора посредством катализаторов-переносчиков, в качестве которых используются ионы металлов или неметаллов переменной валентности. Процесс в общем виде может быть описан следующими уравнениями:
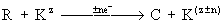 — химическая реакция,
— химическая реакция,
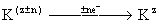 —электрохимическая реакция, где R — исходный продукт, К — катализатор-переносчик, С — конечный продукт, z — степень окисления, n — число электронов (е—), участвующих в реакции.
—электрохимическая реакция, где R — исходный продукт, К — катализатор-переносчик, С — конечный продукт, z — степень окисления, n — число электронов (е—), участвующих в реакции.
Роль электролиза в данном случае сводится к регенерации на электродах химического восстановителя или окислителя, которые при взаимодействии с исходным веществом в электролизе или вне его превращают это вещество в целевой продукт.
Электросинтез находит практическое применение для получения ряда ценных неорганических и органических соединений. Путём электроокисления синтезируют, например, кислородсодержащие соединения хлора в различных степенях окисления.
В промышленности применяют способ получения надсерной (пероксодисерной) кислоты и её солей — персульфатов (см. Пероксосульфаты), основанный на электроокислении серной кислоты и сульфатов. Надсерная кислота и часть её солей используются при производстве перекиси водорода. Перманганат калия получают электроокислением манганата или анодным растворением сплавов марганца с железом — ферромарганца. Двуокись марганца в значительных масштабах производится электролизом сернокислых растворов сульфата марганца.
Электросинтез применяется и при получении различных органических соединений (см. Кольбе реакция).
Электрохимическое фторирование используется для промышленного получения ряда перфторсорганических соединений. Электрохимическим методом получают тетраэтилсвинец и многие другие вещества.
Лит.: Прикладная электрохимия, под ред. А. Л. Ротиняна, 3 изд., Л., 1974; Фиошин М. Я., Успехи в области электросинтеза неорганических соединений, М., 1974; Прикладная электрохимия, под ред. Н. Т. Кудрявцева, 2 изд., М., 1975; Томилов А. П., Фиошин М. Я., Смирнов В. А., Электрохимический синтез органических веществ, Л., 1976; Фистин М. Я., Павлов В. Н., Электролиз в неорганической химии, М., 1976; Электрохимия органических соединений, пер. с англ., М., 1976.
М. Я. Фиошин.
|
Так же Вы можете узнать о... Генеральная войсковая канцелярия, высшее военное и административное учреждение на Левобережной Украине с середины 17 в. Казиранга, национальный парк в Индии, в штате Ассам. Малиновский Марк Прохорович [1851, деревня Пеньково-Романово Борисоглебского уезда Ярославской губернии, — 1877 (по другим сведениям — 1876)], русский рабочий-революционер. Пестик, плодник (pistillum), репродуктивный орган цветка, расположенный в его центре. Советско-финляндская война 1939 —40, возникла в результате политики реакционного правительства Финляндии, превратившего территорию страны в плацдарм для возможного нападения агрессивных держав на СССР. Холтосон, посёлок городского типа в Закаменском районе Бурятской АССР. Аэромагнитная съёмка, изучение магнитного поля Земли с летательного аппарата при помощи аэромагнитометров (см. Гольцы (род рыб) Гольцы, два различных рода рыб: 1) Salvelinus — poд рыб семейства лососёвых, 2 вида (по другим данным — 4): голец (S. Кастекс Рауль Виктор Патрис Кастекс (Castex) Рауль Виктор Патрис (27.10. Меланезийская котловина, в западной части Тихого океана. Поленова Елена Дмитриевна [15(27).11.1850, Петербург, — 7(19). Стая, временная группа рыб или птиц, обычно одного вида, находящихся в сходном биологическом состоянии, активно поддерживающих взаимный контакт и координирующих свои действия; С. Челомей Владимир Николаевич [р. 17(30).6.1914, Седлец], советский учёный в области механики и процессов управления, академик АН СССР (1962; член-корреспондент 1958), дважды Герой Социалистического Труда (1959, 1963). Белокрылая морская свинья (Phocaeňoides dalli), млекопитающее семейства дельфинов. Гэнро, с конца 19 в. и до 1940 внеконституционный орган в Японии, состоявший из приближённых к императору старейших руководящих политических деятелей страны, которые также назывались Г. |
|