Равновесие химическое
Большая Советская Энциклопедия. Статьи для написания рефератов, курсовых работ, научные статьи, биографии, очерки, аннотации, описания.
|
|
| РАА |
| РАБ |
| РАВ |
| РАГ |
| РАД |
| РАЕ |
| РАЁ |
| РАЗ |
| РАИ |
| РАЙ |
| РАК |
| РАЛ |
| РАМ |
| РАН |
| РАО |
| РАП |
| РАР |
| РАС |
| РАТ |
| РАУ |
| РАФ |
| РАХ |
| РАЦ |
| РАЧ |
| РАШ |
Равновесие химическое, состояние системы, в которой обратимо протекает одна или несколько реакций химических, причём для каждой из них скорости прямой и обратной реакций равны, вследствие чего состав системы остаётся постоянным, пока сохраняются условия её существования. В простейшем случае, когда система гомогенна и в ней протекает обратимая химическая реакция А + В Û С + D,
скорость прямой реакции пропорциональна концентрациям реагирующих веществ u1 = k1[A][B],
а скорость обратной реакции пропорциональна концентрациям продуктов реакции u2 = k2[C][D],
где k1 и k2 — соответствующие константы скоростей при данных условиях. В начальный момент, когда [С] и [D] равны нулю, u2 = 0, a u1 определяется начальными концентрациями А и В. По мере расходования этих веществ и образования веществ С и D u1 уменьшается, a u2 возрастает, затем они становятся равными (u1 = u2), т. е. устанавливается Равновесие химическое Из равенства u1 = u2 следует, что 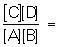 '
'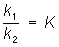
где [С], [D], [А] и [В] — равновесные концентрации реагентов, а К — константа равновесия, зависящая для каждой обратимой реакции от внешних условий. Полученное соотношение есть выражение действующих масс закона; оно характеризует тот предел, до которого может меняться исходный состав системы при самопроизвольном течении реакции в данных условиях, т. е. без затраты работы извне. В условиях Равновесие химическое концентрации (активности) всех реагентов связаны между собой и нельзя изменить ни одной из них без того, чтобы не изменились все остальные. Приведённое выражение для К справедливо в случае газовых реакций при невысоких давлениях и в разбавленных растворах.
Термодинамически Равновесие химическое — и в гомогенных, и в гетерогенных системах — характеризуется как состояние, наиболее устойчивое в данных условиях, т. е. такое, в котором (в зависимости от способа задания внешних условий) та или иная термодинамическая функция состояния (см. Термодинамика химическая) достигает своего минимального или максимального значения. Для изолированных систем, т. е. не обменивающихся веществом и энергией с внешней средой, такой функцией является энтропия. При Равновесие химическое энтропия системы максимальна. Если возможен теплообмен с окружающей средой, но температура и давление в системе постоянны, то минимальное значение принимает изобарно-изотермический потенциал (см. Гиббсова энергия). При постоянстве температуры и объёма минимума достигает изохорно-изотермический потенциал (см. Гельмгольцева энергия).
Зависимость Равновесие химическое от внешних условий в качественной форме выражается Ле Шателье — Брауна принципом, в количественной — соответствующими термодинамическими уравнениями. Так, влияние температуры выражается уравнениями изобары или изохоры реакции.
Изучение Равновесие химическое имеет большое теоретическое и практическое значение, особенно возросшее в связи с проведением процессов в сложных многокомпонентных системах. Большие трудности исследования химических реакций при высоких температурах (высокотемпературная химия) экспериментальными методами вызвали интенсивное развитие расчётов равновесных составов смесей при заданных начальных внешних условиях и исходных концентрациях (или количествах) компонентов. В химической технологии определение положения Равновесие химическое при различных давлениях и температурах и учёт скоростей реакций позволяют выбирать оптимальные условия процесса, в частности условия максимального выхода химических продуктов. Большое значение приобрёл расчёт начального состава смеси по заданному, а также состава квазиравновесных систем, в которых одна или несколько термодинамически возможных реакций практически не осуществляются или в силу своих кинетических особенностей идут очень медленно.
Лит.: Курс физической химии, под общ. ред. Я. И. Герасимова, 2 изд., т. 1, М., 1969; Термодинамические и теплофизические свойства продуктов сгорания. Справочник, т. 1, М., 1971.
М. Е. Ерлыкина.
|
Так же Вы можете узнать о... Гонвед (венг. honvéd, буквально— защитник отечества), название венгерской армии в 19—20 вв. Жданковский, посёлок городского типа в Тульской области РСФСР. Карибу (северный олень) Карибу, общее название североамериканских рас дикого северного оленя. Кру (город в Великобритании) Кру (Crewe), город в Великобритании, в графстве Чешир. Мартынов Евгений Иванович [22.9(4.10).1864, Свеаборг, ныне Суоменлинна, Финляндия,—1932(?)], русский военный историк, генерал-лейтенант (1910). Неустроев Александр Николаевич [14(26).11.1825, Кронштадт, — 13(26). Печ (город в Югославии) Печ (Пећ, Реć), город в Югославии, в Социалистической Республике Сербии, в автономном крае Косово. Реинфекция (от ре... и инфекция), повторное заражение человека или животных возбудителем инфекционного заболевания. Сморчки (Morchella), род съедобных сморчковых грибов; иногда С. Токсикология (от греч. toxikоn — яд и ¼логия), раздел медицины, изучающий свойства ядовитых веществ, механизм их действия на животный организм, сущность вызываемого ими патологического процесса (отравления), методы его лечения и предупреждения. Харкевич Владимир Иванович [сентябрь 1856 — 13(26). Электрическая печь, плавильная или нагревательная печь, в которой используется тепловой эффект электрических явлений. Аргамак (тюрк.), старинное название породистых верховых лошадей в странах Ближнего и Среднего Востока. «Бубновый валет», объединение московских живописцев. Гекуба, Гекаба, в «Илиаде» жена троянского царя Приама, мать Гектора, Париса, Кассандры и др. Дискурсивный (позднелат. discursivus, от discursus — рассуждение, довод, аргумент), рассудочный, понятийный, логический — опосредствованный (в отличие от чувственного, созерцательного, интуитивного, непосредственного). Исмаил-паша (31.12.1830, Каир, — 2.3.1895, Стамбул), правитель Египта в 1863—79. |
|