Комплексные соединения
Большая Советская Энциклопедия. Статьи для написания рефератов, курсовых работ, научные статьи, биографии, очерки, аннотации, описания.
|
|
| КОА |
| КОБ |
| КОВ |
| КОГ |
| КОД |
| КОЖ |
| КОЗ |
| КОИ |
| КОЙ |
| КОК |
| КОЛ |
| КОМ |
| КОН |
| КОО |
| КОП |
| КОР |
| КОС |
| КОТ |
| КОУ |
| КОФ |
| КОХ |
| КОЦ |
| КОЧ |
| КОШ |
| КОЩ |
| КОЭ |
| КОЮ |
| КОЯ |
Комплексные соединения, координационные соединения, химические соединения, состав которых не укладывается в рамки представлений об образовании химических связей за счет неспаренных электронов. Обычно более сложные Комплексные соединения образуются при взаимодействии простых химических соединений. Так, при взаимодействии цианистых солей железа и калия образуется Комплексные соединения — ферроцианид калия: Fe (CN)2 + 4KCN = K4[Fe (CN)6]. Комплексные соединения широко распространены. Общее число уже синтезированных комплексных соединений, по-видимому, превышает число соединений, обычно относимых к простым. Комплексные соединения существуют в растворах, расплавах, в кристаллическом и газообразном состоянии. Переход вещества из одного физ. состояния в другое может приводить к изменению состава и строения Комплексные соединения, к распаду одних комплексных группировок и образованию новых.
Ядро Комплексные соединения (комплекс) составляет центральный атом — комплексообразователь (в приведённом примере Fe) и координированные, т. е. связанные с ним, молекулы или ионы, называемые лигандами (в данном случае кислотный остаток CN). Лиганды составляют внутреннюю сферу комплекса. Бывают Комплексные соединения, состоящие только из центрального атома и лигандов, например карбонилы металлов Ti (CO)7, Cr (CO)6, Fe (CO)5 и др. Если в состав комплекса входят ионы, не связанные непосредственно с центральным атомом, то их выделяют во внешнюю сферу комплекса. Внешнесферными могут быть и катионы, например К+ в K4[Fe (CN)6], и анионы, например SO42- в [Сu (MH3)4] SO4. При записи формулы Комплексные соединения внешнесферные ионы выносятся за квадратные скобки. Комплексная группировка, несущая избыточный положительный электрический заряд, как в [Cu (NH3)4]2+, или отрицательный, как в [Fe (CN)6]4-, называется комплексным ионом. В растворах Комплексные соединения с внешнесферными ионами практически нацело диссоциированы по схеме, например: K2[CoCl4] = 2K++[CoCl4]2- [Cu (NH3)4] SO4 = [Cu (NH3)4]2++SO42-.
Комплексные ионы тоже могут диссоциировать в растворе. Например: [CoCl4]2-Û Co2++4Cl-.
Устойчивость Комплексные соединения в растворе определяется константой диссоциации К его комплексного иона:  .
.
(При записи константы диссоциации в квадратные скобки берут равновесные концентрации ионов). Константа диссоциации характеризует термодинамическую устойчивость комплекса, зависящую от энергии связи между центральным атомом и лигандом. Различают также кинетическую устойчивость, или инертность, комплексной группировки — неспособность комплексного иона быстро обменивать внутрисферные ионы или молекулы на другие адденды. Например, [Fe (H2O)6]3+ и [Сr (H2O)6]3+ имеют почти одинаковые энергии связи Me — H2O (116 и 122 ккал/моль), но первый комплекс обменивает лиганды быстро, а второй (инертный) — медленно.
Число ионов или молекул, непосредственно связанных с центральным атомом, называется его координационным числом (К. ч.). Например, в Комплексные соединения K4[Fe (CN)6], Ti (CO)7 и [Сu (NH3)4] SO4 К. ч. центральных атомов равны, соответственно, 6, 7 и 4. К. ч. у различных комплексообразователей различны. Их значения меняются в зависимости от размеров и химической природы центральных атомов и лигандов. В настоящее время известны К. ч. от 1 до 12, однако чаще всего приходится иметь дело с К. ч.4 и 6.
Составные части Комплексные соединения чрезвычайно разнообразны. В качестве центральных атомов-комплексообразователей чаще всего выступают атомы переходных элементов (Ti, V, Cr, Mn, Fe, Со, Ni, Си, Zn, Zr, Nb, Mo, Fe, Ru, Rh, Pd, Ag, Cd, Hf, Ta, W, Re, Os, lr, Pt, Au, Hg, редкоземельные элементы, элементы группы актиноидов), а также некоторые неметаллы, например В, Р, Si. Лигандами могут быть анионы кислот (F-, Cl-, Br-, I-, CN-, NO-2, SO42-, PO43- и др.) и самые разнообразные нейтральные органические и неорганические молекулы и радикалы, содержащие атомы О, N, Р, S, Se, С.
Комплексные соединения с анионами кислот во внутренней сфере (ацидокомплексы) — наиболее типичные представители неорганических комплексов. Самым распространённым лигандом является вода. При растворении простых солей в воде образуются аквокомплексы, например, по схеме CoCl2 + 6H2O=[Co (H2O)6]2++ 2Cl. Кристаллические аквокомплексы называются кристаллогидратами.
При растворении солей в различных органических и неорганических жидкостях образуются разнообразные сольватокомплексы. Кристаллические сольватокомплексы называют кристаллосольватами. К ним относятся продукты присоединения аммиака — аммиакаты, например [Ni (NH3)6] Cl2, продукты присоединения спирта — алкоголяты, эфира — эфираты и т. д. Сложные молекулы присоединяются к центральному атому через атомы кислорода (вода, спирты, эфиры и т. п.), азота (аммиак, его органические производные — амины), фосфора (PCl3, производные фосфина), углерода и др. Часто лиганд присоединяется к центральному атому несколькими из своих атомов. Такие лиганды называют полидентатными. Среди сложных органических производных встречаются лиганды, координирующиеся двумя, тремя, четырьмя, пятью, шестью и даже восемью атомами (соответственно би-, три-, тетра-, пента-, гексаи октадентатные лиганды). Полидентатные органические лиганды могут образовать циклические комплексы типа неэлектролитов (см. Внутрикомплексные соединения), например: 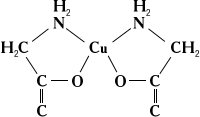
Самыми лучшими лигандами в смысле устойчивости образуемых ими Комплексные соединения являются комплексоны — аминополикарбоновые кислоты, среди которых наибольшее распространение получила этилендиаминтетрауксусная кислота (HOOCCH2)2NCH2CH2N (CH2COOH)2 (комплексон II, ЭДТА).
Неорганические ацидолиганды обычно моно-, реже бидентатны. Например, в соединении (NH4)2[Ce (NO3)6] каждая NO3-группа присоединяется к атому церия двумя атомами кислорода и является бидентатной. К. ч. Се в этом соединении равно 12.
Между Комплексные соединения и обычными (простыми) соединениями нет определённой границы. Одни и те же вещества, в зависимости от поставленных задач исследования, часто можно рассматривать и как простые и как комплексные. Например, в любом кристаллическом неорганическом веществе атомы, обычно относимые к комплексообразователям, обладают определённым К. ч. и, следовательно, ближайшей сферой, принципиально не отличимой от аналогичной группировки в обычном Комплексные соединения
Теория строения Комплексные соединения берёт своё начало от представлений А. Вернера (1893), который ввел важные для целого исторического периода понятия «главной» и «побочной» валентности, а также представления о координации, координационном числе, геометрии комплексной молекулы. Значительный вклад в исследование химии Комплексные соединения, и, в частности, в установление связи между строением Комплексные соединения и реакционной способностью координированных групп, внесли советские учёные Л. А. Чугаев, И. И. Черняев и др.
Однако классическая координационная теория оказалась бессильной объяснить причины образования Комплексные соединения некоторых новых классов, предсказать их строение, а также установить взаимосвязь между строением и физическими свойствами Комплексные соединения
Удовлетворительное разрешение этих вопросов стало возможным лишь на базе современных квантово-механических представлений о природе химической связи. Подробнее см. Валентность, Квантовая химия, Молекулярных орбиталей метод, Химическая связь.
Комплексные соединения находят широкое применение для выделения и очистки платиновых металлов, золота, серебра, никеля, кобальта, меди, в процессах разделения редкоземельных элементов, щелочных металлов и в ряде других технологических процессов. Комплексные соединения широко используют в химическом анализе для качественного обнаружения и количественного определения самых разнообразных элементов. В живых организмах различные типы Комплексные соединения представлены соединениями ионов металлов (Fe, Cu, Mg, Mn, Mo, Zn, Со) с белками (т. н. металлопротеиды), а также витаминами, коферментами, транспортными и др. веществами, выполняющими специфические функции в обмене веществ. Особенно велика роль природных Комплексные соединения в процессах дыхания, фотосинтеза, окисления биологического, в ферментативном катализе.
Лит.: Современная химия координационных соединений, под ред. Дж. Льюиса и Р. Уилкинса, пер. с англ., М., 1963; Берсукер И. Б., Аблов А. В., Химическая связь в комплексных соединениях, Кишинев, 1962; Гринберг А. А., Введение в химию комплексных соединений, 2 изд., Л. — М., 1951; Дей К., Селбин Д., Теоретическая неорганическая химия, пер. с англ., М., 1971; Головня В. А., Федоров И. А., Основные понятия химии комплексных соединений, М., 1961; Яцимирский К. Б., Термохимия комплексных соединений, М., 1951; Коттон Ф., Уилкинсон Дж., Современная неорганическая химия, пер. с англ., ч. 1—3, М., 1969.
Б. Ф. Джуринский.
|
Так же Вы можете узнать о... Кулексы (Culex), род комаров семейства Culicidae. Лилонгве (Lilongwe), города Малави, на р. . Мандибулы (лат. mandibula — челюсть, от mando — жую, грызу), первая пара челюстей у ракообразных, многоножек и насекомых; то же, что жвалы. Микула Селянинович, один из героев русских былин, богатырь-пахарь. Мясокомбинат, промышленное предприятие по убою скота и переработке мяса и др. Нормандский полуостров, полуостров на северо-западе Франции; см. Отечественной войны орден Отечественной войныорден, см. в статье Ордена СССР. Петрушевский Дмитрий Моисеевич [1(13).9.1863, с. Посошное, посошное обложение, сошное, государственный поземельный налог в России 16—17 вв. Радиокомпас, автоматический радиокомпас, самолётный радиопеленгатор для автоматической пеленгации наземных передающих радиостанций. Рудник, горнопромышленное предприятие, в основном по подземной добыче руд, горно-химического сырья и стройматериалов. Семема (от греч. semáino — обозначаю), термин, образованный по аналогии с терминами фонема, морфема и обозначающий единицу языкового плана содержания, которая соотносится с морфемой (минимальной единицей плана выражения) как совокупность компонентов её содержания (сем). Сокаль, город (с 1939), центр ского района Львовской области УССР. Суворов Евгений Константинович [14(26). 1.1880, Петербург, — 30. Тешик-Таш, Тешикташ, пещера в горах Байсунтау (Сурхандарьинская область Узбекской ССР), где в 1938—39 советским археологом А. Углерод (латинское Carboneum), С, химический элемент IV группы периодической системы Менделеева, атомный номер 6, атомная масса 12,011. Фланкирование зубчатых колёс, технологическая операция при изготовлении зубчатых колёс, заключающаяся в удалении части профиля зуба и применяемая для уменьшения погрешностей в равномерном расположении зубьев на колесе (ошибок основного шага), которые вызывают дополнительную динамическую нагрузку, повышают вибрации и шум зубчатой передачи. Хордовые (Chordata), высший тип вторичнополостных животных. Чугаева реакция, ксантогеновая реакция, превращение спиртов в олефины термическим разложением метилксантогенатов (см. |
|