Вода
Большая Советская Энциклопедия. Статьи для написания рефератов, курсовых работ, научные статьи, биографии, очерки, аннотации, описания.
|
|
| ВОА |
| ВОБ |
| ВОВ |
| ВОГ |
| ВОД |
| ВОЕ |
| ВОЖ |
| ВОЗ |
| ВОИ |
| ВОЙ |
| ВОК |
| ВОЛ |
| ВОМ |
| ВОН |
| ВОО |
| ВОП |
| ВОР |
| ВОС |
| ВОТ |
| ВОХ |
| ВОЧ |
| ВОШ |
| ВОЩ |
| ВОЯ |
Вода, окись водорода, H20, простейшее устойчивое в обычных условиях химическое соединение водорода с кислородом (11,19% водорода и 88,81% кислорода по массе), молекулярная масса 18,0160; бесцветная жидкость без запаха и вкуса (в толстых слоях имеет голубоватый цвет), Вода принадлежит важнейшая роль в геологической истории Земли и возникновении жизни, в формировании физической и химической среды, климата и погоды на нашей планете. Без Вода невозможно существование живых организмов. Вода — обязательный компонент практически всех технологических процессов — как сельскохозяйственного, так и промышленного производства.
Вода в природе. Вода широко распространена в природе. Гидросфера — водная оболочка Земли, включающая океаны, моря, озёра, водохранилища, реки, подземные Вода, почвенную влагу, составляет около 1,4—1,5 млрд. км3, причём на долю Вода суши приходится всего около 90 млн. км3. Из них подземные воды составляют 60, ледники 29, озёра 0,75, почвенная влага 0,075, реки 0,0012 млн. км3. В атмосфере Вода находится в виде пара, тумана и облаков, капель дождя и кристаллов снега (всего около 13—15 тыс. км3). Около 10% поверхности суши постоянно занимают ледники. На севере и северо-востоке СССР, на Аляске и Севере Канады — общей площадью около 16 млн. км2 всегда сохраняется подпочвенный слой льда (всего около 0,5 млн. км3. В земной коре — литосфере содержится, по разным оценкам, от 1 до 1,3 млрд. км3 Вода, что близко к содержанию её в гидросфере. В земной коре значительные количества Вода находятся в связанном состоянии, входя в состав некоторых минералов и горных пород (гипс, гидратированные формы кремнезёма, гидросиликаты и др.). Огромные количества Вода (13—15 млрд. км3) сосредоточены в более глубоких недрах мантии Земли. Выход Вода, выделявшейся из мантии в процессе разогревания Земли на ранних стадиях её формирования, и дал, по современным воззрениям, начало гидросфере. Ежегодное поступление Вода из мантии и магматических очагов составляет около 1 км3. Имеются данные о том, что Вода, хотя бы частично, имеет «космическое» происхождение: протоны, пришедшие в верхнюю атмосферу от Солнца, захватив электроны, превращаются в атомы водорода, которые, соединяясь с атомами кислорода, дают H2O. Вода входит в состав всех живых организмов, причём в целом в них содержится лишь вдвое меньше Вода, чем во всех реках Земли. В живых организмах количество Вода, за исключением семян и спор, колеблется между 60 и 99,7% по массе. По словам французского биолога Э. Дюбуа-Реймона, живой организм есть l'eau animée (одушевлённая вода). Все воды Земли постоянно взаимодействуют между собой, а также с атмосферой, литосферой и биосферой (см. Влагооборот, Водный баланс)/
Вода в природных условиях всегда содержит растворённые соли, газы и органические вещества. Их количественный состав меняется в зависимости от происхождения Вода и окружающих условий. При концентрации солей до 1 г/кг Вода считают пресной, до 25 г/кг — солоноватой, свыше — солёной.
Наименее минерализованными Вода являются атмосферные осадки (в среднем около 10—20 мг/кг), затем пресные озёра и реки (50—1000 мг/кг). Солёность океана колеблется около 35 г/кг; моря имеют меньшую минерализацию (Чёрное 17—22 г/кг; Балтийское 8—16 г/кг; Каспийское 11—13 г/кг). Минерализация подземных Вода вблизи поверхности в условиях избыточного увлажнения составляет до 1 г/кг, в засушливых условиях до 100 г/кг, в глубинных артезианских Вода минерализация колеблется в широких пределах. Максимальные концентрации солей наблюдаются в соляных озёрах (до 300 г/кг) и глубокозалегающих подземных Вода (до 600 г/кг).
В пресных Вода обычно преобладают ионы HCO3-, Са2+ и Mg2+. По мере увеличения общей минерализации растет концентрация ионов SO42-, Cl-, Na+ и К+. В высо-коминерализованных Вода преобладают ионы Cl- и Na+, реже Mg2+ и очень редко Ca2+. Прочие элементы содержатся в очень малых количествах, хотя почти все естественные элементы периодической системы найдены в природных Вода
Из растворённых газов в природных Вода присутствуют азот, кислород, двуокись углерода, благородные газы, редко сероводород и углеводороды. Концентрация органических веществ невелика — в среднем в реках около 20 мг/л, в подземных Вода ещё меньше, в океане около 4 мг/л. Исключение составляют Вода болотные и нефтяных месторождений и Вода, загрязнённые промышленными и бытовыми стоками, где количество их бывает выше. Качественный состав органических веществ чрезвычайно разнообразен и включает различные продукты жизнедеятельности организмов, населяющих Вода, и соединения, образующиеся при распаде их остатков.
Первоисточниками солей природных Вода являются вещества, образующиеся при химическом выветривании изверженных пород (Ca2+, Mg2+, Na+, К+ и др.), и вещества, выделявшиеся на протяжении всей истории Земли из её недр (CO2, SO2, HCI, NH3 и др.). От разнообразия состава этих веществ и условий, в которых происходило их взаимодействие с Вода, зависит состав Вода Громадное значение для состава Вода имеет и воздействие живых организмов (см. также Гидрохимия).
Изотопный состав Вода В связи с существованием двух стабильных изотопов у водорода (1H и 2H, обычно обозначаемые Н и D) и трёх у кислорода (16O,17O и 18O) известно 9 изотопных разновидностей Вода, которые находятся в природной Вода в среднем в следующих соотношениях (в молярных %): 99,73 H216O; 0,04 H217O; 0,20 H218O, 0,03 HD’16O, а также 10-5—10-15%(суммарно) HD17O, HD18O, D216O, D217O, D218O. Особый интерес представляет тяжёлая вода D2O, содержащая дейтерий. В Вода Земли находится всего13—20 кг «сверхтяжёлой» Вода. содержащей радиоактивный изотоп водорода — тритий (3H, или Т).
Историческая справка. Благодаря широкой распространённости Вода и её роли в жизни людей, она издавна считалась первоисточником жизни. Представление философов античности о Вода как о начале всех вещей нашло отражение в учении Аристотеля (4 в. до н. э.) о четырёх стихиях (огне, воздухе, земле и Вода), причём Вода считалась носителем холода и влажности. Вплоть до конца 18 в. в науке существовало представление о Вода как об индивидуальном химическом элементе. В 1781—82 английский учёный Г. Кавендиш впервые синтезировал Вода, взрывая электрической искрой смесь водорода и кислорода, а в 1783 французский учёный А. Лавуазье, повторив эти опыты, впервые сделал правильный вывод, что Вода есть соединение водорода и кислорода. В 1785 Лавуазье совместно с французским учёным Ж. Менье определил количественный состав Вода В 1800 английские учёные У. Николсон и А. Карлейль разложили Вода на элементы электрическим током. Таким образом, анализ и синтез Вода показали сложность её состава и позволили установить для неё формулу H2O. Изучение физических свойств В. началось ещё до установления её состава в тесной связи с другими научно-техническими проблемами. В 1612 итальянский учёный Г. Галилей обратил внимание на меньшую плотность льда сравнительно с жидкой Вода как на причину плавучести льда. В 1665 голландский учёный Х. Гюйгенс предложил принять температуру кипения и температуру плавления Вода за опорные точки шкалы термометра. В 1772 французский физик Делюк нашёл, что максимум плотности Вода лежит при 4°С; при установлении в конце 18 в. метрической системы мер и весов это наблюдение было использовано для определения единицы массы — килограмма. В связи с изобретением паровой машины французские учёные Д. Араго и П. Дюлонг (1830) изучили зависимость давления насыщенного пара Вода от температуры. В 1891—97 Д. И. Менделеев дал формулы зависимости плотности Вода от температуры. В 1910 американский учёный П. Бриджмен и немецкий учёный Г. Тамман обнаружили у льда при высоком давлении несколько полиморфных модификаций. В 1932 американские учёные Э. Уошберн и Г. Юри открыли тяжёлую Вода Развитие физических методов исследования позволило существенно продвинуться в изучении структуры молекул В., а также строения кристаллов льда. В последние десятилетия особое внимание учёных привлекает структура жидкой Вода и водных растворов.
Физические свойства и строение Вода Важнейшие физические константы Вода приведены в табл. 1. О давлении насыщенного пара Вода при разных температурах см. в ст. Пар водяной. О полиморфных модификациях Вода в твёрдом состоянии см. в ст. Лёд. Тройная точка для Вода, где находятся в равновесии жидкая Вода, лёд и пар, лежит при температуре +0,01°С и давлении 6,03·10-3атм.
Многие физические свойства Вода обнаруживают существенные аномалии. Как известно, свойства однотипных химических соединений у элементов, находящихся в одной и той же группе периодической системы Менделеева, изменяются закономерно. В ряду водородных соединений элементов VI группы (H2Te, H2Se, H2S, H2O) температуры плавления и кипения закономерно уменьшаются лишь у первых трёх; для Вода эти температуры аномально высоки. Плотность Вода в интервале 100—4°С нормально возрастает, как и у огромного большинства других жидкостей. Однако, достигнув максимального значения 1,0000 г/см3 при +3,98°С, при дальнейшем охлаждении уменьшается, а при замерзании скачкообразно падает, тогда как почти у всех остальных веществ кристаллизация сопровождается увеличением плотности. Вода способна к значительному переохлаждению, т. е. может оставаться в жидком состоянии ниже температуры плавления (даже при —30°С). Удельная теплоёмкость, удельная теплота плавления и кипения Вода аномально высоки по сравнению с другими веществами, причём удельная теплоёмкость Вода минимальна при 40°С. Вязкость Вода с ростом давления уменьшается, а не повышается, как следовало бы ожидать по аналогии с другими жидкостями. Сжимаемость Вода крайне невелика, причём с ростом температуры уменьшается.
Табл. 1. — Физические свойства воды
|
Свойство | Значение |
|
Плотность, г/см3 |
|
|
лёд . . . . . . . . . . . . . . . . . . |
0,9168 (0°С) |
|
жидкость . . . . . . . . . . . . |
0,99987 (0°С) 1,0000 (3,98°С) 0,99823 (20°С) |
|
пар насыщенный . . . . . . |
0,5977 кг/м3 (100°С) |
|
Темп-ра плавления . . . . . |
0°С |
|
Темп-ра кипения . . . . . . . |
100°С |
|
Критич. темп-ра . . . . . . . . |
374,15°С |
|
Критич. давление . . . . . . . |
218,53 кгс/см2 |
|
Критич. плотность . . . . . . |
0,325 г/см3 |
|
Теплота плавления . . . . . . |
79,7 кал/г |
|
Теплота испарения . . . . . . |
539 кал/г (100°С) |
|
Уд. теплопроводность, кал/(см·сек·град) |
|
|
лёд . . . . . . . . . . . . . . . . . . |
5,6·10-3 (0°С) |
|
жидкость . . . . . . . . . . . . |
1,43·10-3 (0°С) 1,54·10-3 (45°С) |
|
пар насыщенный . . . . . . |
5,51·10-5 (100°С) |
|
Уд. электропроводность, ом--1·см-1 |
|
|
лёд . . . . . . . . . . . . . . . . . . |
0,4·10-8 (0°С) |
|
жидкость . . . . . . . . . . . . |
1,47·10-8 (0°С) 4,41·10-8 (18°С) 18,9·10-8 (50°С) |
|
Уд. теплоёмкость кал/(г·град) |
|
|
жидкость . . . . . . . . . . . . |
1,00 (15°С) |
|
пар насыщенный . . . . . . |
0,487 (100°С) |
|
Диэлектрическая проницаемость |
|
|
лёд . . . . . . . . . . . . . . . . . . |
74,6 (°С) |
|
жидкость . . . . . . . . . . . . |
81,0 (20°С) |
|
пар насыщенный |
1,007 (145°С) |
|
Вязкость, спз |
|
|
жидкость . . . . . . . . . . . . |
1,7921 (0°С) 0,284 (100°С) |
|
Поверхностное натяжение жидкой воды на границе с
|
74,64 (0°С) 62,61 (80°С) |
|
Показатель прелом ления (D — линия |
1,33299 (20°С) |
|
Скорость звука в во де . . . . . . . . . . . . . . . . . . . |
1,496 м/сек (25°С) |
Примечание: 1 кал/(см·сек·град) = 418,68 вт/(м·К); 1 ом-–1·см-–1 = 100 сим/м;
1 кал/(г·град) =.4,186 кдж (кг·К); 1 спз = 10—3н·сек/м2; 1 дин/см = 10–3н/м.
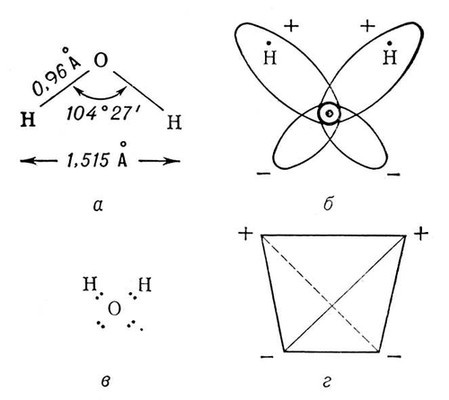
Аномалии физических свойств В. связаны со структурой её молекулы и особенностями межмолекулярных взаимодействий в жидкой Вода и льде. Три ядра в молекуле Вода образуют равнобедренный треугольник с протонами в основании и кислородом в вершине (рис. 1, а). Распределение электронной плотности в молекуле Вода таково (рис. 1, б, в), что создаются 4 полюса зарядов: 2 положительных, связанных с атомами водорода, и 2 отрицательных, связанных с электронными облаками необобществлённых пар электронов атома кислорода. Указанные 4 полюса зарядов располагаются в вершинах тетраэдра (рис. 1, г). Благодаря этой полярности Вода имеет высокий дипольный момент (1,86 D), а четыре полюса зарядов позволяют каждой молекуле Вода образовать четыре водородные связи с соседними (такими же) молекулами (например, в кристаллах льда).
Рис. 1. Структура молекулы воды: а — геометрия молекулы H2O (в парообразном состоянии); б — электронные орбиты в молекуле H2O; в — электронная формула молекулы H2O (видны необобществленные электронные пары); г — четыре полюса зарядов в молекуле H2O расположены в вершинах тетраэдра.
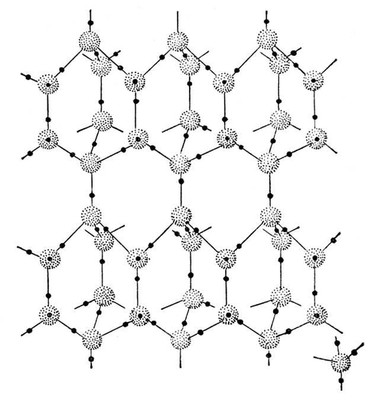
Кристаллическая структура обычного льда гексагональная (рис. 2), она «рыхлая», в ней много «пустот». (При плотной «упаковке» молекул В. в кристаллах льда его плотность составляла бы около 1,6 г/см3.) В жидкой Вода присущая льду связь каждой молекулы H2O с четырьмя соседними («ближний порядок») в значительной степени сохраняется; однако «рыхлость» структуры при плавлении льда уменьшается, молекулы «дальнего порядка» попадают в «пустоты», что ведёт к росту плотности Вода При дальнейшем нагревании Вода возрастает тепловое движение молекул, расстояние между ними увеличивается, т. е. происходит расширение Вода, которое начиная с +3,98°С уже преобладает, и поэтому далее с ростом температуры плотность Вода уменьшается. Водородные связи примерно в 10 раз прочнее, чем связи, обусловленные межмолекулярными взаимодействиями, характерными для большинства других жидкостей; поэтому для плавления, испарения, нагревания Вода необходима гораздо большая энергия, чем в случае других жидкостей, что объясняет отмеченные аномально высокие значения теплот плавления и испарения и удельной теплоёмкости. С повышением температуры водородные связи разрываются, однако определённое их число сохраняется даже при 100°С. Растворённая в органических растворителях Вода состоит из образовавшихся за счёт водородных связей ассоциатов (H2O)2.
Рис. 2. Кристаллическая структура льда.
Вода как растворитель. Вода — наиболее универсальный растворитель. Газы достаточно хорошо растворяются в Вода, если способны вступать с ней в химическое взаимодействие (аммиак, сероводород, сернистый газ, двуокись углерода). Прочие газы мало растворимы в Вода При понижении давления и повышении температуры растворимость газов в Вода уменьшается. Многие газы при низких температурах и повышенном давлении не только растворяются в Вода, но и образуют кристаллогидраты (аргон, криптон, ксенон, хлор, сероводород, углеводороды и др.). В частности, пропан при 10°С и 0,3 мн/м2 (3 кгс/см2) даёт кристаллогидрат C3H8·17H2O. При уменьшении давления такие гидраты распадаются. Кристаллогидраты многих газообразных веществ, образующиеся при низких температурах, содержат Вода в «пустотах» своих кристаллов (так называемые клатраты, см. Соединения включения).
Вода — слабый электролит, диссоциирующий по уравнению: 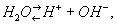
причём количественной характеристикой электролитической диссоциации Вода служит ионное произведение Вода: Кв= [Н+] [ОН-], где [Н+] и [ОН-] — концентрация соответствующих ионов в г-ион/л; Кв составляет 10-14 (22°С) и 72·10-14 (100°С), что соответствует усилению диссоциации Вода с ростом температуры (см. также Водородный показатель).
Будучи электролитом, Вода растворяет многие кислоты, основания, минеральные соли. Такие растворы проводят электрический ток благодаря диссоциации растворённых веществ с образованием гидратированных ионов (см. Гидратация). Многие вещества при растворении в Вода вступают с ней в реакцию обменного разложения, называемую гидролизом. Из органических веществ в Вода растворяются те, которые содержат полярные группы (—ОН, —NH2, — СООН и др.) и имеют не слишком большую молекулярную массу. Сама Вода хорошо растворима (или смешивается во всех отношениях) лишь в ограниченном числе органических растворителей. Однако в виде ничтожной примеси к органическим веществам Вода присутствует практически всегда и способна резко изменять физические константы последних.
Вода любого природного водоёма содержит в растворённом состоянии различные вещества, преимущественно соли (см., например, Жёсткость воды). Благодаря высокой растворяющей способности Вода, получить её в чистом виде весьма трудно. Обычно мерой чистоты Вода служит её электропроводность. Дистиллированная Вода, полученная перегонкой обычной Вода, и даже повторно перегнанный дистиллят имеют электропроводность примерно в 100 раз более высокую, чем у абсолютно чистой Вода Наиболее чистую Вода получают синтезом из тщательно очищенного кислорода и водорода в спец. аппаратуре.
В последние годы появились многочисленные сообщения о существенном изменении свойств технической и дистиллированной Вода после её протекания с определённой скоростью в магнитных полях оптимальной (весьма невысокой) напряжённости. Эти изменения носят временный характер и через 10—25 часов постепенно и самопроизвольно исчезают. Отмечается, что после такой «магнитной обработки» ускоряются процессы кристаллизации растворённых в Вода веществ, адсорбции, изменяется смачивающая способность Вода и др. Хотя теоретическое объяснение этих явлений пока отсутствует, они уже находят широкое практическое применение — для предотвращения образования накипи в паровых котлах, для улучшения процессов флотации, очистки Вода от взвесей и др.
Образование и диссоциация Вода Образование Вода при взаимодействии водорода с кислородом сопровождается выделением теплоты 286 кдж/моль (58,3 ккал/моль) при 25°С (для жидкой Вода). Реакция 2H2 + O2= 2H2O до температуры 300°С идёт крайне медленно, при 550°С — со взрывом. Присутствие катализатора (например, платины) позволяет реакции идти при обычной температуре. Спокойное горение водорода в кислороде, как и взрывное взаимодействие, — это цепные реакции, идущие с участием радикалов свободных.
Химические свойства Вода В обычных условиях Вода — достаточно устойчивое соединение. Распад молекул H2O (термическая диссоциация) становится заметным лишь выше 1500°С. Разложение Вода происходит также под действием ультрафиолетового (фотодиссоциация) или радиоактивного излучения (радиолиз). В последнем случае, кроме H2 и O2, образуется также перекись водорода и ряд свободных радикалов. Характерным химическим свойством Вода является способность её вступать в реакции присоединения, а также гидролитические разложения взаимодействующих веществ. Восстановители действуют на Вода преимущественно при высокой температуре. Только наиболее активные из них, как щелочные и щелочноземельные металлы, реагируют с Вода уже при комнатной температуре с выделением водорода и образованием гидроокисей: 2Na + 2H2O = 2NaOH + Н2; Ca + 2H2O = Ca (OH)2 + H2. Магний и цинк взаимодействуют с Вода при кипячении, алюминий — после удаления с его поверхности окисной плёнки. Менее активные металлы вступают в реакцию с Вода при красном калении: 3Fe + 4H2O = Fe3O4 + 4H2. Медленное взаимодействие многих металлов и их сплавов с Вода происходит при обычной температуре. Используя Вода, содержащую изотоп кислорода 18O, удалось показать, что при коррозии железа во влажной атмосфере «ржавчина» получает кислород именно из Вода, а не из воздуха (см. Коррозия металлов). Благородные металлы — золото, серебро, платина, палладий, рутений, родий, а также ртуть с Вода не взаимодействуют.
Атомарный кислород превращает Вода в перекись водорода: H2O + O = H2O2. Фтор уже при обычной температуре разлагает Вода: F2 + H2O 2HF + О. Одновременно образуются также H2O2, озон, окись фтора F2O и молекулярный кислород O2. Хлор при комнатной температуре даёт с Вода хлористоводородную и хлорноватистую кислоты: Cl2 + H2O = HCl + HClO. Бром и иод в этих условиях реагируют с Вода аналогичным образом. При высоких температурах (100°С для хлора, 550°С для брома) взаимодействие идёт с выделением кислорода: 2Cl2 + 2H2O = 4HCl + O2. Фосфор восстанавливает Вода и образует метафосфорную кислоту (только в присутствии катализатора под давлением при высокой температуре): 2P + 6H2O = 2HPO3 + 5H2. С азотом и водородом Вода не взаимодействует, а с углеродом при высокой температуре даёт водяной газ: С + H2O = CO + H2. Эта реакция может служить для промышленного получения водорода, как и конверсия метана: CH4 + H2O = CO + 3H2 (1200—1400°С). Вода взаимодействует со многими основными и кислотными окислами, образуя соответственно основания и кислоты. Присоединение Вода к молекулам непредельных углеводородов лежит в основе промышленного способа получения спиртов, альдегидов, кетонов (см. также Гидратация). Вода участвует во многих химических процессах как катализатор. Так, взаимодействие щелочных металлов или водорода с галогенами, многие окислительные реакции не идут в отсутствие хотя бы ничтожных количеств В.
Вода, химически связанную с веществом, в которое она входит (неразличимую в виде «готовых» молекул H2O), называют конституционной; молекулы H2O образуются лишь в момент разложения вещества, например при сильном нагревании: Ca (OH)2 = CaO + H2O. Вода, входящая в состав ряда кристаллических веществ (например, алюминиевых квасцов K2SO4·Al2 (SO4)3·24H2O) и различимая в этих кристаллах рентгенографически, называется кристаллизационной или кристаллогидратной. Вода, поглощённую твёрдыми веществами, имеющими большое число пор и развитую поверхность (например, активным углём), называют адсорбционной. Свободную Вода, заполняющую тонкие канальцы (например, в почве), называют гигроскопической (капиллярной) Вода Различают также структурно-свободную Вода, располагающуюся в пустотах некоторых структур, например в минералах. Качественно можно обнаружить Вода в виде конденсата, образующегося при нагревании исследуемого образца; проводя нагревание при непрерывном взвешивании, получают количественные результаты (термогравиметрический анализ). В органических растворителях Вода можно обнаружить по окрашиванию бесцветной сернокислой меди CuSO4, образующей с Вода синий кристаллогидрат CuSO4·5H2O. Отделить и количественно определить Вода часто удаётся азеотропной отгонкой её с бензолом, толуолом или другой жидкостью в виде азеотропной смеси, после расслоения которой при охлаждении измеряют объём отделившейся Вода
Применение Вода в промышленности. Невозможно указать другое вещество, которое бы находило столь разнообразное и широкое применение, как Вода Вода — химический реагент, участвующий в производстве кислорода, водорода, щелочей, азотной кислоты, спиртов, альдегидов, гашёной извести и многих других важнейших химических продуктов. Вода — необходимый компонент при схватывании и твердении вяжущих материалов — цемента, гипса, извести и т.п. Как технологический компонент для варки, растворения, разбавления, выщелачивания, кристаллизации Вода применяется в многочисленных производственных процессах. В технике Вода служит энергоносителем (см. Гидроэнергетика),теплоносителем (паровое отопление, водяное охлаждение), рабочим телом в паровых машинах (см. Пар водяной), используется для передачи давления (в частности, в гидравлических передачах и прессах, а также при нефтедобыче) или для передачи мощности (см. Гидропривод машин). Вода, подаваемая под значительным давлением через сопло, размывает грунт или породу (см. Гидромеханизация).
Требования, предъявляемые к Вода в промышленности, весьма разнообразны. Вода особой чистоты необходима для развития новейших отраслей промышленности (производство полупроводников, люминофоров, атомная техника и др.). Поэтому особое внимание уделяется в настоящее время вопросам водоподготовки и водоочистки. По некоторым оценкам, общий объём ежегодно перерабатываемых материалов (руды, уголь, нефть, минералы и т.д.) составляет во всём мире около 4 млрд. м3 (4 км3); в то же время потребление свежей Вода (т. е. Вода из источников водоснабжения) только промышленностью СССР составило в 1965 37 млрд. м3. Стремительный рост потребления Вода ставит перед человечеством новую важную проблему — борьбы с истощением и загрязнением водных ресурсов планеты (см. Водные ресурсы).
Лит.: Вернадский Вода И., История природных вод, Избр. соч., т. 4, М., 1960; Горизонты биохимии, пер. с англ., М., 1964; Некрасов Б. Вода, Основы общей химии, т. 1, М., 1965; Фюрон Р., Проблемы воды на земном шаре, пер. с франц., М., 1966; Круговорот воды, М., 1966; Паундер Э., Физика льда, пер. с англ., М., 1967; Виноградов А. П., Введение в геохимию океана, М., 1967; Самойлов О. Я., Структура водных растворов электролитов и гидратация ионов, М., 1957; Изотопный анализ воды, 2 изд., М., 1957; Термодинамика и строение растворов, М., 1959; Краткая химическая энциклопедия, т. 1, М., 1961, с. 605—14.
Вода Л. Василевский.
Вода в организме — основная среда (внутриклеточная и внеклеточная), в которой протекает обмен веществ у всех растений, животных и микроорганизмов, а также субстрат ряда химических ферментативных реакций. В процессе фотосинтеза Вода вместе с углекислым газом вовлекается в образование органических веществ и, таким образом, служит материалом для создания живой материи на Земле.
Табл. 2. — Содержание воды в различных организмах, их органах и тканях
|
Организмы, органы, ткани |
Содержание воды, % |
|
Растения (наземные) |
|
|
верхушка растущего побега |
91—93 |
|
листья . . . . . . . . . . . . . . . . . |
75—86 |
|
Семена злаков . . . . . . . . . . . |
12—14 |
|
Водоросли . . . . . . . . . . . . . . . |
90—98 |
|
Мхи, лишайники . . . . . . . . . . |
5—7 |
|
Медузы . . . . . . . . . . . . . . . . . |
95–98 |
|
Дождевые черви . . . . . . . . . . |
84 |
|
Насекомые |
|
|
взрослые . . . . . . . . . . . . . . . |
45—65 |
|
личинки . . . . . . . . . . . . . . . . |
58—90 |
|
Рыбы . . . . . . . . . . . . . . . . . . . |
70 |
|
Млекопитающие (в т. ч. |
63—68 |
|
скелет . . . . . . . . . . . . . . . . . |
20—40 |
|
мышцы . . . . . . . . . . . . . . . . . |
75 |
|
печень . . . . . . . . . . . . . . . . . |
75 |
|
Мозг человека . . . . . . . . . . . . |
|
|
серое вещество . . . . . . . . . . |
84 |
|
белое вещество . . . . . . . . . . |
72 |
Вода обеспечивает тургор тканей, перенос питательных веществ и продуктов обмена (кровь, лимфа, сок растений), физическую терморегуляцию (см. Транспирация, Потоотделение) и другие процессы жизнедеятельности. Жизнь, вероятно, возникла в водной среде. В ходе эволюции различные водные животные и водные растения вышли на сушу и приспособились к наземному образу жизни; тем не менее и для них Вода — важнейший компонент внешней среды. Жизнь без Вода невозможна. При недостатке Вода жизнедеятельность организмов нарушается. Лишь покоящиеся формы жизни — споры, семена — хорошо переносят длительное обезвоживание. Растения при отсутствии Вода увядают и могут погибнуть, но чувствительность различных растений к недостатку Вода неодинакова (см. Засухоустойчивость, Ксерофиты, Мезофиты). Животные, если лишить их Вода, быстро погибают: упитанная собака может прожить без пищи до 100 дней, а без Вода — менее 10. Содержание Вода в организмах велико (см. табл. 2).
В жидкостях организма — межклеточных пространствах, лимфе, крови, пищеварительных соках, соке растений и др. — содержится свободная Вода В тканях животных и растений Вода находится в связанном состоянии — она не вытекает при рассечении органа. Вода способна вызывать набухание коллоидов, связываться с белком и другими органическими соединениями, а также с ионами, входящими в состав клеток и тканей (гидратационная Вода). Молекулы Вода, находящиеся внутри клеток, но не входящие в состав гидратационных оболочек ионов и молекул, представляют иммобильную Вода, легче гидратационной вовлекаемую в общий круговорот Вода в организме (см. Водно-солевой обмен, Всасывание, Выделение).
Лит.: Зюков А. М., Обмен воды в организме. Физиология и патология, Хар., [1929]; Данилов Н. Вода, Физиологические основы питьевого режима, М., 1956; Кравчинский Б. Д., Физиология водно-солевого обмена жидкостей тела, Л., 1963.
Гигиеническое значение Вода Вода входит в состав всех жидкостей и тканей человеческого тела, составляя около 65% всей его массы. Потеря Вода опаснее для организма, чем голодание: без пищи человек может прожить больше месяца, без Вода — всего лишь несколько дней. В Вода растворяются важные для жизнедеятельности организма органические и неорганические вещества; она способствует электролитической диссоциации содержащихся в ней солей, кислот и щелочей, выполняет роль катализатора разнообразных процессов обмена веществ в организме.
Физиологическая потребность человека в Вода, которая вводится в организм с питьём и с пищей, в зависимости от климатических условий составляет 3—6 л в сутки. Значительно большее количество Вода необходимо для санитарных и хозяйственно-бытовых нужд.
Лишь при достаточном уровне водопотребления, которое обеспечивается централизованными системами водоснабжения, оказывается возможным удаление отбросов и нечистот при помощи сплавной канализации. Уровень водопотребления (в л на 1 жителя в сутки) в известной мере определяет и уровень санитарной. культуры в населённых местах (см. табл. 3).
Табл. 3. — Нормативы хозяйственно-питьевого водопотребления
|
Степень благоустройства районов жилой застройки |
Водопотребление на 1 жит, л/сут (среднесуточное, |
|
Здания с водопользованием |
30—50 |
|
Здания с внутренним водо проводом и канализацией |
125—150 |
|
Здания с водопроводом, ка нализацией, ваннами и во донагревателями, работаю щими на твёрдом топливе |
150—180 |
|
То же с газовыми нагрева телями |
180—230 |
|
Здания с водопроводом, ка нализацией и системой |
275—400 |
Для предупреждения опасности прямого или косвенного отрицательного влияния Вода на здоровье и санитарные условия жизни населения большое значение имеют научно-обоснованные гигиенические нормативы предельно допустимого содержания в Вода химических веществ. Эти нормативы являются основой государственных стандартов качества питьевой Вода (ГОСТ — 2874) и обязательны при проектировании и эксплуатации хозяйственно-питьевых (коммунальных) водопроводов. В интересах здравоохранения в 60-х гг. 20 в. во всех социалистических странах, в США, Франции были пересмотрены стандарты качества питьевой Вода Международные стандарты питьевой Вода были опубликованы Всемирной организацией здравоохранения (ВОЗ) в 1963; в 1968 закончена разработка проекта нового стандарта качества питьевой Вода в СССР.
Потребление Вода населением должно быть безопасно в эпидемиологическом отношении; Вода не должна содержать болезнетворных бактерий и вирусов. Водный путь распространения характерен для возбудителей холеры, брюшного тифа, паратифов и лептоспирозов, в известной мере также для возбудителей дизентерии, туляремии, эпидемического гепатита, бруцеллёза. С Вода в организм человека могут попадать цисты дизентерийной амёбы, яйца аскарид и др. Эпидемиологическая безопасность Вода обеспечивается очисткой сточных вод и их обеззараживанием, мерами санитарной охраны водоёмов, очисткой и обеззараживанием водопроводной Вода
Показателями безопасности Вода в эпидемиологическом отношении являются: 1) общее количество бактерий (выращиваемых на питательной среде — агаре при t 37°С) — не более 100 в 1 мл; 2) количество кишечных палочек (выращиваемых на плотной питательной среде с концентрацией на мембранных фильтрах) — не более 3 в 1 л. При использовании жидких сред накопления титр кишечной палочки должен быть не менее 300. По проекту ГОСТа (1968) к бактериям группы кишечной палочки относятся грамотрицательные неспороносные палочки, факультативные анаэробы, способные сбраживать глюкозу с образованием кислоты и газа при t 35—37°С в течение 24 часов.
Природный состав Вода издавна привлекал к себе внимание как возможная причина массовых заболеваний неинфекционной природы. Содержание в Вода хлоридов, сульфатов и продуктов разложения органических веществ (аммиак, нитриты и нитраты) рассматривалось лишь как косвенный показатель опасного для здоровья населения загрязнения Вода бытовыми стоками. Благодаря применению новых методов исследования были обнаружены районы с недостатком или избытком в Вода тех или иных микроэлементов. В этих районах наблюдаются своеобразные изменения флоры и фауны. В связи с недостаточным или избыточным поступлением в организм микроэлементов с Вода и с пищей, среди населения отмечаются характерные заболевания. Так, развитие эндемического флюороза вызывается недостаточным содержанием фтора в питьевой Вода, причём выявлена прямая связь между концентрацией фтора в Вода и частотой и тяжестью поражения зубов. Фтор питьевой Вода оказывает также влияние на фосфорно-кальциевый обмен и на процесс кальцификации костей. Для фтора питьевой Вода характерен малый диапазон концентраций от токсических до физиологически полезных. В связи с этим установлено, что содержание фтора в питьевой Вода не должно превышать 0,7—1,0 мг/л (до 1,2 при фторировании Вода) в зависимости от климатических условий. Долгое время существовало представление о содержащихся в Вода нитратах как о косвенных показателях бытового загрязнения Вода Однако наличие повышенных концентраций нитратов обнаруживается и в природных подземных Вода и даже в Вода артезианских водоносных горизонтов (Молдавская ССР, Татарская АССР, район Владивостока). Использование в молочных смесях для детского питания Вода, содержащей повышенные концентрации нитратов, вызывает у детей метгемоглобинемию разной тяжести. Водонитратная метгемоглобинемия встречается и у детей старших возрастов, поэтому она приобретает черты эндемического заболевания. (См. табл. 4).
Табл. 4. — Показатели безвредности химических веществ (природных и добавляемых в процессе обработки) в питьевой воде
|
Наименование ингредиентов и веществ | Содержание в |
|
Свинец . . . . . . . . . . . . |
0,1 |
|
Мышьяк . . . . . . . . . . . |
0,05 |
|
Фтор . . . . . . . . . . . . . . |
0,7—1,5 |
|
Берилий . . . . . . . . . . . |
0,0002 |
|
Молибден . . . . . . . . . |
0,5 |
|
Нитраты (по N) . . . . . |
10,0 |
|
Полиакриламид (ПАА) |
2,0 |
|
Стронций . . . . . . . . . . |
2,0 |
Первые водные интоксикации были отмечены во 2-й половине 19 в. в Западной Европе (свинцовые «эпидемии») вследствие применения свинцовых труб в водопроводной технике (применение таких труб в СССР запрещено). Свинец обнаруживается и в Вода подземных источников, в концентрациях, которые не безразличны для организма из-за возможности длительного действия.
Среди химических веществ, обнаруживаемых в питьевых Вода, могут встречаться также вещества, которые в небольших концентрациях изменяют органолептические свойства Вода (запах, вкус, прозрачность и пр.). Наиболее часто органолептические свойства Вода изменяют содержащиеся химические вещества, в природных Вода (соли общей минерализации, железо, марганец, медь, цинк и др.), остаточные количества соединений, используемые как реагенты при обработке Вода, а также промышленные загрязнения водоёмов.
Показатели, обеспечивающие благоприятные органолептические свойства Вода, приведены в табл. 5.
Табл. 5.—Показатели благоприятных органолептических свойств воды при содержании в ней природных или добавляемых в процессе очистки веществ
|
Наименование ингредиентов и веществ |
Содержание в воде, мг/л, не более |
|
Мутность по стандарт ной шкале . . . . . . . . . . . |
1,5 |
|
Железо . . . . . . . . . . . . . . |
0,3 |
|
Марганец . . . . . . . . . . . . |
0,5 |
|
Медь . . . . . . . . . . . . . . . . |
1,0 |
|
Цинк . . . . . . . . . . . . . . . . |
5,0 |
|
Хлориды . . . . . . . . . . . . . |
350 |
|
Сульфаты . . . . . . . . . . . . |
500 |
|
Сухой остаток . . . . . . . . . |
1000 |
|
Триполифосфат . . . . . . . |
5,0 |
|
Гексаметафосфат . . . . . |
5,0 |
В случае применения Вода для обработки серебра остаточная концентрация его не должна быть больше 0,05 мг/л. Для органолептических свойств В. также существуют нормативы: запах и привкус на уровне 2 баллов, цветность по шкале —20°, жёсткость —7,0 мг/экв и pH в пределах 6,5—9,0. При содержании в Вода одновременно хлоридов, сульфатов, марганца, меди, цинка сумма их концентраций, выраженная в долях от максимально допустимых концентраций каждого вещества, не должна превышать 1.
Лит.: Руководство по коммунальной гигиене, т. 2, М., 1962; Вернадский Вода И., Биогеохимические очерки. 1922—1932 гг., М. — Л., 1940; Международные стандарты питьевой воды, 2 изд., пер., М., 1964.
С. Н. Черкинский.
|
Так же Вы можете узнать о... Водонапорные системы, бассейны подземных вод, выделяемые с учётом всех закономерностей формирования и распространения подземных вод. Ихтиозавры (Ichthyopterygia), подкласс вымерших мезозойских пресмыкающихся; наибольшего распространения достигали в юрский период. Мен Томас Мен, Ман (Mun) Томас (1571—1641), английский экономист, представитель развитого меркантилизма. Пруссачество, реакционные, милитаристские традиции господствующих классов Пруссии, а после 1871 объединённой вокруг неё Германии; в исторической литературе под П. Трихоплакс (Trichoplax adhaerens), примитивное морское многоклеточное животное (из группы фагоцителлозоа), листовидное тело которого (до 3 мм) состоит из наружного слоя клеток со жгутиками и внутренней паренхимы, образованной амёбообразными клетками. Аладжа (современный даг), гора на Карсском плоскогорье, восточнее Карса, в районе которой в сентябре — октябре 1877 произошли два сражения в ходе русско-турецкой войны 1877 — 78 на Кавказском театре. Гиббсит (по имени американского минералога Дж. Кипарисиакос, Кипариссийский залив (Kyparissiakos kolpos), открытый залив Ионического моря, у западного берега полуострова Пелопоннес (Греция). Наги Мухаммед (27.1.1888, Александрия, — 5.4. Ружевич Тадеуш Ружевич (Róžewicz) Тадеуш (р. Флагман (голл. vlagman, от vlag – флаг и man – человек), 1) командующий флотом, или командир соединения кораблей, которому присвоен должностной флаг (см. Ашаффенбург (Aschaffenburg), город в ФРГ, в земле Бавария, на р. Двойникование, образование в монокристалле областей с закономерно измененной ориентацией кристаллической структуры. Красностойкость, теплостойкость, способность стали сохранять при нагреве до температур красного каления высокую твёрдость и износостойкость, полученные в результате термической обработки. Опак (франц. opaque, от лат. opacus — непрозрачный), высший сорт фаянса. Следоуказатель, приспособление к посевному агрегату (одноили двух-сеялочному) для обеспечения параллельности рядков семян при последующих проходах. Черноморский, посёлок городского типа в Северском районе Краснодарского края РСФСР. Брянта, река в Амурской области РСФСР, правый приток р. Застава (военная), 1) орган охранения войск на марше (головная, боковая, тыльная походные З. |
|