Рений
Большая Советская Энциклопедия. Статьи для написания рефератов, курсовых работ, научные статьи, биографии, очерки, аннотации, описания.
|
|
| РЕА |
| РЕБ |
| РЕВ |
| РЕГ |
| РЕД |
| РЕЕ |
| РЕЖ |
| РЕЗ |
| РЕИ |
| РЕЙ |
| РЕК |
| РЕЛ |
| РЕМ |
| РЕН |
| РЕО |
| РЕП |
| РЕР |
| РЕС |
| РЕТ |
| РЕУ |
| РЕФ |
| РЕХ |
| РЕЦ |
| РЕЧ |
| РЕШ |
| РЕЭ |
| РЕЮ |
| РЕЯ |
Рений (Rhenium), Re, химический элемент VII группы периодической системы Менделеева, атомный номер 75, атомная масса 186,207. Светло-серый металл. В природном Р. два изотопа: стабильный 185Re (37,07%) и слаборадиоактивный 187Re (с периодом полураспада T1/2 = 1011 лет).
В 1871 Д. И. Менделеев предсказал существование элемента с атомным весом 190 — аналога марганца — и назвал его «тримарганцем». В последующие годы появлялось много недостоверных сообщений об открытии этого элемента. Но лишь в 1925 нем. химики И. и В. Ноддак обнаружили его спектральным методом в минерале колумбите. Название Р. происходит от латинского наименования р. Рейн (Rhenus) в Германии.
Распространение в природе. Р. — типичный рассеянный элемент. Среднее содержание его в земной коре 7×108% по массе. Известны три минерала Р. — окисел, сульфид и сульфоренат меди CuReS4 (минерал джезказганит). Как примесь Р. встречается в минералах других[ элементов; его повышенные концентрации отмечены в колумбитах, танталитах, цирконатах, минералах редких земель, сульфидах меди и особенно в молибдените MoS2 (от 0,1 до 10-5%). Связь Р. с молибденитом обусловлена изоморфизмом MoS2 и ReS2. Важный источник Р. — некоторые медные сульфидные концентраты (0,002—0,005% Re).
Физические и химические свойства. Р. кристаллизуется в гексагональной плотноупакованной решётке (а = 2,760 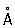 , с = 4,458
, с = 4,458 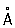 ). Атомный радиус 1,373
). Атомный радиус 1,373 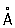 , ионный радиус Re7+ 0,56
, ионный радиус Re7+ 0,56 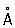 . Плотность 21,03 г/см3,tпл= 3180 ± 20 °С, tkип= 5900 °С. Удельная теплоёмкость 153 дж/(кг×К), или 0,03653 кал/(г×град) (0—1200 °С). Термический коэффициент линейного расширения 6,7×10-6 (20—500 °С). Удельное объёмное электрическое сопротивление 19,3×10-6 ом×см (20 °С). температура перехода в состояние сверхпроводимости 1,699 К; работа выхода 4,80 эв, парамагнитен.
. Плотность 21,03 г/см3,tпл= 3180 ± 20 °С, tkип= 5900 °С. Удельная теплоёмкость 153 дж/(кг×К), или 0,03653 кал/(г×град) (0—1200 °С). Термический коэффициент линейного расширения 6,7×10-6 (20—500 °С). Удельное объёмное электрическое сопротивление 19,3×10-6 ом×см (20 °С). температура перехода в состояние сверхпроводимости 1,699 К; работа выхода 4,80 эв, парамагнитен.
По тугоплавкости Р. уступает лишь вольфраму. В отличие от вольфрама, Р. пластичен в литом и рекристаллизованном состоянии и деформируется на холоду. Модуль упругости Р. 470 Гн/м2, или 47 000 кгс/мм2 (выше, чем у других металлов, за исключением Os и Ir). Это обусловливает высокое сопротивление деформации и быстрый наклёп при обработке давлением. Р. отличается высокой длительной прочностью при температурах 1000—2000 °С.
У атома Re семь внешних электронов; конфигурация высших энергетических уровней 5d56s2. На воздухе при обычной температуре Р. устойчив. Окисление металла с образованием окислов (ReOs, Re2O7) наблюдается начиная с 300 °С и интенсивно протекает выше 600 °С. С водородом Р. не реагирует вплоть до температуры плавления. С азотом не взаимодействует вообще. Р., в отличие от других тугоплавких металлов, не образует карбидов. Фтор и хлор реагируют с Р. при нагревании с образованием ReFe и ReCl5, с бромом и йодом металл непосредственно не взаимодействует. Пары серы при 700—800 °С дают с Р. сульфид ReS2.
Р. не корродирует в соляной и плавиковой кислотах любых концентраций на холоду и при нагревании до 100 °С. В азотной кислоте, горячей концентрированной серной кислоте, в перекиси водорода металл растворяется с образованием рениевой кислоты. В растворах щелочей при нагревании Р. медленно корродирует, расплавленные щёлочи растворяют его быстро.
Для Р. известны все валентные состояния от +7 до —1, что обусловливает многочисленность и разнообразие его соединений. Наиболее устойчивы соединения семивалентного Р. Рениевый ангидрид ReO7 — светло-жёлтое вещество, хорошо растворимое в воде. Рениевая кислота HReO4 — бесцветная, сильная; сравнительно слабый окислитель (в отличие от марганцевой HMnO4). При взаимодействии HReO4 с щелочами, окислами или карбонатами металлов образуются её соли — перренаты. Соединения иных степеней окисления Р. — оранжево-красная трёхокись ReO3, тёмно-коричневая двуокись ReO2, легколетучие хлориды и оксихлориды ReCI5, ReOCl4, ReO3CI и др.
Получение и применение. Основным источником Р. служат молибденитовые концентраты (с содержанием Re 0,01—0,04%) и медные концентраты некоторых месторождений меди (с содержанием Re 0,002—0,003%). При окислительном обжиге молибденитовых концентратов (см. Молибден) Р. удаляется с печными газами в виде Re2O7(tкип 360 °С), которая концентрируется в продуктах пылеуловительных систем (шламах, растворах). На различных стадиях производства черновой меди из концентратов Р. также удаляется с газами. Если печные газы направляются в производство серной кислоты, Р. концентрируется в промывной кислоте электрофильтров. Для извлечения Р. из пылей и шламов применяют выщелачивание слабой H2SO4 с добавкой окислителя — пиролюзита. Из полученных растворов, а также из промывной серной кислоты Р. извлекают сорбцией или экстракцией. Конечным продуктом является перренат аммония NH4ReO4. Восстанавливая его водородом, получают порошок P., превращаемый затем в компактные заготовки методом порошковой металлургии. Применяют также плавку Р. в электроннолучевых печах. Как тугоплавкий металл P., а также сплавы W с Re используют в производстве электронных приборов. Кроме того, из Р. и его сплавов с W изготавливают термопары для измерения температур до 2500 °С, электроконтакты и детали точных приборов. Сплавы Re с W, Mo, Ta отличаются высокой жаропрочностью. Они применяются в авиаи космической технике. Р. и его соединения используются в качестве эффективных катализаторов при крекинге нефти.
Лит.: Друце И., Рений, пер. с англ., М., 1951; Лебедев К. Б., Рений, М., 1963; Савицкий Е. М., Тылкина М. А., Поварова К. Б., Сплавы рения, М., 1965; Труды III Всесоюзного совещания по проблеме рения, ч. 1—2, М., 1970.
А. Н. Зеликман.
|
Так же Вы можете узнать о... Эмполи (Empoli), город в Центральной Италии, в Тоскане, в провинции Флоренция, на р. Береговые ласточки (Riparia), род птиц отряда воробьиных. Гетероауксин (от гетеро... и ауксин), бета-индолилуксусная кислота, C10H9NO2, химическое вещество высокой физиологической активности, образующееся в растениях и влияющее на ростовые процессы (т. Золотистые водоросли (Chrysophyta), отдел (тип) низших растений. Кох (сов. цирковые артистки) Кох (настоящая фамилия — Кухарж-Кох), сестры, русские советские цирковые артистки, акробатки, гимнастки, эквилибристки. Минск, столица БССР. Один из крупнейших промышленных, культурных и научных центров СССР. Переключение в физиологии, одна из закономерностей деятельности нервной системы, обеспечивающая более совершенное приспособление организма к окружающей среде. Сан-Фернандо (город в Чили) Сан-Фернандо (San Fernando), город в Центральном Чили, в Продольной долине. Титр (в иммунохимич. анализе) Титр в иммунохимическом анализе, максимальное или оптимальное разведение антигенов, антител или комплемента, при котором возможны регистрация положительной реакции между антигенами и антителами или стандартизация реакции по одному или обоим компонентам. Четырнадцатый съезд ВКП(б), состоялся 18 — 31 декабря 1925 в Москве. Аристов Николай Александрович (р. 1847 — год смерти неизвестен), русский историк-востоковед и этнограф. Водозаборное сооружение, водозабор, гидротехническое сооружение, осуществляющее забор воды из источника питания (реки, озера, водохранилища и др. Доломитовые Альпы (Alpi Dolomiti), горный массив в Восточных Альпах на северо-востоке Италии. Кио Эмиль Теодорович Кио (псевдоним; настоящая фамилия Ренард) Эмиль Теодорович [30. Мазутная топка, топка для сжигания отходов нефтепереработки — мазута. Оквикская культура, локальный вариант древнеберингоморской культуры, бытовавший у эскимосов побережья и островов Берингова м. Разумовские, русский дворянский род, представители которого, получив графские и княжеские титулы, занимали важнейшие государственные и дипломатические посты в 18 — середине 19 вв. |
|