Фосфаты
Большая Советская Энциклопедия. Статьи для написания рефератов, курсовых работ, научные статьи, биографии, очерки, аннотации, описания.
|
|
| ФОБ |
| ФОВ |
| ФОГ |
| ФОД |
| ФОЙ |
| ФОК |
| ФОЛ |
| ФОМ |
| ФОН |
| ФОР |
| ФОС |
| ФОТ |
| ФОФ |
| ФОХ |
| ФОШ |
Фосфаты.
Фосфаты, соли и эфиры фосфорных кислот. Из солей различают ортофосфаты и полимерные (или конденсированные) Фосфаты Последние делят на полифосфаты, имеющие линейное строение фосфат-анионов, метафосфаты с кольцеобразным (циклическим) фосфат-анионом и ультрафосфаты с сетчатой, разветвленной структурой фосфат-аниона. К Фосфаты относят также весьма стойкие соединения – фосфаты бора BPO4 и алюминия AlPO4 (хотя правильнее было бы считать их смешанными ангидридами P2O5 и B2O3; P2O5 и Al2O3).
Ортофосфаты – соли ортофосфорной кислоты H3PO4 – известны одно-, двухи трёхзамещённые. Однозамещённые ортофосфаты, содержащие анион H2PO4, растворимы в воде, из двухи трёхзамещённых ортофосфатов, содержащих соответственно анионы HPO42- и PO43-, растворимы только соли щелочных металлов и аммония. Трёхзамещённые ортофосфаты, за исключением триаммоний фосфата (NH4)3PO4×3H2O, термически устойчивы; трикальцийфосфат заметно диссоциирует лишь при температурах выше 2000 °С (диссоциация улучшается под вакуумом): Ca3(PO4)2 = 3CaO + P2O5. При нагревании однои двухзамещённых ортофосфатов происходит их дегидратация с выделением структурной воды и образованием полимерных (линейных или кольцевых) фосфатов по схеме: (n-2) MeH2PO4 (2Me2HPO4 (Men + 2PnO3n + 1 + (n-1) H2O
(где n – степень полимеризации).
Все встречающиеся в природе соединения фосфора представляют собой ортофосфаты (см. Фосфаты природные). В промышленности растворимые в воде ортофосфаты получают по следующей схеме: 1) производство из природных Фосфаты (главным образом апатитов) ортофосфорной кислоты (см. Фосфорные кислоты); 2) взаимодействие ортофосфорной кислоты с гидроокисями, аммиаком, хлоридами или карбонатами, например: H3PO4 + MH3 = NH4H2PO4 H3PO4 + KCl = KH2PO4 – HCl
Труднорастворимые ортофосфаты тяжелых металлов (например, Ag, Cu) образуются в результате обменных реакций, например: 2Na2HPO4 + 3AgNO3 = Ag3PO4 + 3NaNO3 + NaH2PO4
Полимерные Фосфаты различных структурных типов могут быть описаны формулами: линейные полифосфаты Men + 2PnO3n + 1, или 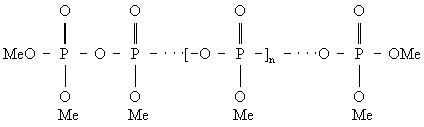
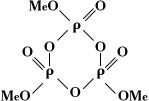
кольцевые метафосфаты MenPnO3n, или 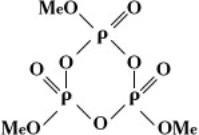
(где n – степень полимеризации).
Свойства полимерных Фосфаты зависят от характера катиона, строения фосфат-аниона, степени полимеризации, структуры фосфата и др. Так, например, растворимость линейных полифосфатов, как правило, падает с увеличением степени полимеризации, но может быть увеличена путём модифицирования полифосфатов, например изменением скорости охлаждения расплава.
Получают полимерные Фосфаты (линейные и кольцевые) в основном термической дегидратацией однои двухзамещённых ортофосфатов или нейтрализацией соответствующих полиили мета(циклических) фосфорных кислот: Hn + 2PnO3n + 1 + nNH3 = (NH4) n H2PnO3n + 1
(иногда эти процессы совмещаются, как, например, при высокотемпературной аммонизации ортофосфорной кислоты для получения полифосфатов аммония). В промышленных масштабах эти способы используют для получения пиро-, триполифосфатов натрия (соответственно Na4P2O7, Na5P3O10) и в меньшей степени – калия, а также полимерных метафосфатов (натрий-фосфатные стекла, метафосфат калия и др.).
Из циклических метафосфатов наиболее изучены тримета-, тетрамета-, гексаметаи октаметафосфаты.
Ультрафосфаты – соединения общей формулы MenRPnOn (5 + R)/2, где R = Me2O/P2O5, как правило, аморфные, стеклообразные вещества, гигроскопичные, легко гидролизующиеся на воздухе с образованием полии метафосфатов. Последние в присутствии большого количества воды могут гидролизоваться за счёт полного расщепления Р–О–Р-связей вплоть до ортофосфатов. Выделенные в кристаллическом виде ультрафосфаты кальция, магния, марганца и некоторых лантаноидов, как правило, не гигроскопичны. Ультрафосфаты образуются в результате термической дегидратации смеси ортофосфатов с фосфорными кислотами или с фосфорным ангидридом, т. е. при наличии условия О < Me2O/P2O5 < 1.
Фосфаты кальция, аммония, калия и др. широко применяются в качестве фосфорных удобрений. В 70-е гг. 20 в. выросло производство кормовых фосфатов [например, обесфторенные Фосфаты, преципитат, динатрийфосфат, фосфаты мочевины – H3PO4×(NH2)2CO и др.]. Фосфаты натрия и калия (особенно триполифосфаты) применяют в качестве компонентов жидких и порошкообразных моющих средств и поверхностно-активных веществ при буровых работах, в цементной, текстильной промышленности при подготовке шерсти, хлопка к белению и крашению. Фосфаты используют в пищевой промышленности в качестве рыхлителей теста, например (NH4)2HPO4. Некотоpые Фосфаты (например, BPO4) применяют в качестве катализаторов в реакциях органического синтеза. Фосфаты преимущественно щелочных металлов входят в состав эмалей, глазурей, стекол, огнестойких материалов (как антипирены), а также мягких абразивов; они используются при фосфатировании металлов (Mg, Fe, Zn). Кристаллы однозамещённых фосфатов калия, аммония применяются как сегнетоэлектрики и пьезоэлектрические материалы. Фосфаты используются в фармацевтической промышленности при изготовлении лекарственных препаратов (например, фосфакол, АТФ – аденозинтрифосфат и др.), зубных паст и порошков.
Л. В. Кубасова.
Из эфиров фосфорных кислот наиболее известны одно-, двухи трёхзамещённые ортофосфаты, соответственно ROP (O)(OH)2, (RO)2P (O) OH и (KO)3PO (где R – алкил, арил или гетероциклический остаток). Получаются при взаимодействии POCl3 со спиртами: POCl3 + 3ROH ® (RO)3PO POCl3 + 2ROH ® (RO)2P (O) Cl 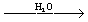 (RO)2P (O) OH
(RO)2P (O) OH
и др. способами.
Применяются как пестициды, присадки к маслам, экстрагенты и т.д. Некоторые органические Фосфаты (нуклеиновые кислоты, аденозинфосфорные кислоты) выполняют важные функции в живых организмах.
Э. Е. Нифантьев.
Лит.: Продан Е. А., Продан Л. И., Ермоленко Н. Фосфаты, Триполифосфаты и их применение, Минск, 1969; см. также лит. при ст. Фосфор.
|
Так же Вы можете узнать о... Дюпон де Немур Пьер Самюэль Дюпон де Немур (Dupont de Nemours) Пьер Самюэль (14. Карлюдовика (Carludovica), род растений семейства циклантовых. Кургальджинский, посёлок городского типа, центр Кургальджинского района Целиноградской области Казахской ССР. Метамерия (в химии) Метамерия в химии, частный случай изомерии, связанный с положением гетероатома в цепи алифатических соединений. Октябрьский (пос. гор. типа в Гомельской обл.) Октябрьский, посёлок городской типа, центр Октябрьского района Гомельской области БССР, в 3 км от ж. Предел, одно из основных понятий математики. Северо-Байкальское нагорье, нагорье на северо-востоке от оз. Тара (упаковка) Тара (итальянское tara, от арабское тарха — то, что отброшено), изделие, служащее для упаковки, хранения и транспортировки товаров. Фотокатод ,катод электровакуумного прибора, эмиттирующий электроны под действием света (см. Экваториальные координаты, две системы небесных координат, в которых основным кругом служит небесный экватор, а полюсом — полюс мира. Артавазд II (ум. 31 до н. э.), царь Армении Великой в 56—34 до н. Валуев Дмитрий Александрович Валуев (Волуев) Дмитрий Александрович [14(26). Годовский Леопольд Годовский (Godowski) Леопольд (13.2.1870, Сошлы, близ Вильнюса, — 21. |
|