Буферные системы
Большая Советская Энциклопедия. Статьи для написания рефератов, курсовых работ, научные статьи, биографии, очерки, аннотации, описания.
|
|
| БУА |
| БУБ |
| БУВ |
| БУГ |
| БУД |
| БУЕ |
| БУЖ |
| БУЗ |
| БУИ |
| БУЙ |
| БУК |
| БУЛ |
| БУМ |
| БУН |
| БУО |
| БУР |
| БУС |
| БУТ |
| БУФ |
| БУХ |
| БУЦ |
| БУЧ |
| БУШ |
| БУЭ |
| БУЮ |
| БУЯ |
Буферные системы, буферные растворы, буферные смеси, системы, поддерживающие определённую концентрацию ионов водорода Н+, то есть определённую кислотность среды. Кислотность буферных растворов почти не изменяется при их разбавлении или при добавлении к ним некоторых количеств кислот или оснований.
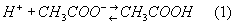 |
Примером Буферные системы служит смесь растворов уксусной кислоты CH3COOH и её натриевой соли CH3COONa. Эта соль как сильный электролит диссоциирует практически нацело, т. е. даёт много ионов CH3COO-. При добавлении к Буферные системы сильной кислоты, дающей много ионов Н+, эти ионы связываются ионами CH3COO- и образуют слабую (то есть мало диссоциирующую) уксусную кислоту:
Наоборот, при подщелачивании Буферные системы, то есть при добавлении сильного основания (например, NaOH), ионы OH- связываются Н+-ионами, имеющимися в Буферные системы благодаря диссоциации уксусной кислоты; при этом образуется очень слабый электролит — вода:
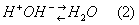 |
По мере расходования Н+-ионов на связывание ионов OH- диссоциируют всё новые и новые молекулы CH3COOH, так что равновесие (1) смещается влево. В результате, как в случае добавления Н+-ионов, так и в случае добавления ОН--ионов, эти ионы связываются и потому кислотность раствора практически не меняется.
Кислотность растворов принято выражать так называемым водородным показателем pH (для нейтральных растворов pH=7, для кислых — pH меньше, а для щелочных — больше 7). Приливание к 1 л чистой воды 100 мл 0,01 молярного раствора HCl (0,01 М) изменяет pH от 7 до 3. Приливание того же раствора к 1 л Буферные системы CH3COOH + CH3COONa (0,1 М) изменит pH от 4,7 до 4,65, то есть всего на 0,05. В присутствии 100 мл 0,01 М раствора NaOH в чистой воде pH изменится от 7 до 11, а в указанной Буферные системы лишь от 4,7 до 4,8. Кроме рассмотренного, имеются многочисленные другие Буферные системы (примеры см. в табл.). Кислотность (и, следовательно, pH) Буферные системы зависит от природы компонентов, их концентрации, а для некоторых Буферные системы и от температуры. Для каждой Буферные системы pH остаётся примерно постоянным лишь до определённого предела, зависящего от концентрации компонентов.
Примеры буферных систем|
Компоненты (концентрации по 0,1 г мол/л) |
pH (при 15—250C) |
|
Уксусная кислота + ацетат натрия, CH3COOH + CH3COONa |
4,7 |
|
Лимоннокислый натрий (двузамещеный), C6H6O7Na2 |
5,0 |
|
Борная кислота + бура, Н3ВО3 + Na2B4O7 10H2O |
8,5 |
|
Борная кислота + едкий натр, Н3ВО3 + NaOH. |
9,2 |
|
Фосфат натрия (двузамещеный)+ + едкий натр, Na2HPO4 + NaOH |
11,5 |
Буферные системы широко используются в аналитической практике и в химическом производстве, так как многие химические реакции идут в нужном направлении и с достаточной скоростью лишь в узких пределах pH. Буферные системы имеют важнейшее значение для жизнедеятельности организмов; они определяют постоянство кислотности различных биологических жидкостей (крови, лимфы, межклеточных жидкостей). Основные Буферные системы организма животных и человека: бикарбонатная (угольная кислота и её соли), фосфатная (фосфорная кислота и её соли), белки (их буферные свойства определяются наличием основных и кислотных групп). Белки крови (прежде всего гемоглобин, обусловливающий около 75% буферной способности крови) обеспечивают относительную устойчивость pH крови. У человека pH крови равен 7,35—7,47 и сохраняется в этих пределах даже при значительных изменениях питания и др. условий. Чтобы сдвинуть pH крови в щелочную сторону, необходимо добавить к ней в 40—70 раз больше щёлочи, чем к равному объёму чистой воды. Естественные Буферные системы в почве играют большую роль в сохранении плодородия полей.
В. Л. Василевский.
|
Так же Вы можете узнать о... Мангыт, династия ханов Бухары (1753—1920), сменившая династию Аштарханидов. Антонеску Ион Антонеску (Antonescu) Ион [2(14). 6.1882, Питешти, — 1. Оферта (от лат. offero — предлагаю), предложение заключить гражданско-правовой договор, содержащее все его существенные условия. Волны Мартено, электрический музыкальный инструмент, сконструированный французским изобретателем М. Рыкалин Николай Николаевич [р. 14(27).9.1903, Одесса], советский учёный в области сварки и металлургии, академик АН СССР (1968; член-корреспондент 1953). Жабник (Filago), род однолетних травянистых растений семейства сложноцветных; прежде Ж. Токовые весы, ампер-весы, прибор, используемый для воспроизведения единицы силы электрического тока — ампера. Конференция (позднелат. conferentia, от лат. Шемсеттин Сами (Şemsettin Sami) (1. Минускульное письмо, древнее, а также средневековое латинское и греческое (в т. Барзани Мустафа Барзани мулла Мустафа аль-Барзани (р. 14.5.1903), политический деятель Ирака. Пирофорные металлы (от греч. pýr — огонь и phoros — несущий), металлы, способные в тонкораздробленном виде воспламеняться на воздухе. Герасимов Михаил Прокофьевич [30.9(12.10).1889—1939], русский советский поэт. Сибирские летописи, русские летописи конца 16—18 вв. Изостазия, изостатическое равновесие (от греч. Уровенная поверхность в геодезии, поверхность, во всех точках которой потенциал силы тяжести имеет одинаковую величину. Курень (шалаш) Курень (тюрк.),1) на Украине — шалаш, сторожка (на огородах, бахчах и т. Эритропоэтин (от греч. erythros — красный и poietikos — образующий), гормон, стимулирующий образование эритроцитов в костном мозге. Народные художественные промыслы, одна из форм народного художественного творчества (в частности, изготовление изделий декоративно-прикладного искусства). |
|