Валентность (химич.) 3. Современные квантово-химические представления о валентности
Большая Советская Энциклопедия. Статьи для написания рефератов, курсовых работ, научные статьи, биографии, очерки, аннотации, описания.
|
|
| ВАА |
| ВАБ |
| ВАВ |
| ВАГ |
| ВАД |
| ВАЕ |
| ВАЖ |
| ВАЗ |
| ВАИ |
| ВАЙ |
| ВАК |
| ВАЛ |
| ВАМ |
| ВАН |
| ВАП |
| ВАР |
| ВАС |
| ВАТ |
| ВАУ |
| ВАФ |
| ВАХ |
| ВАЦ |
| ВАЧ |
| ВАШ |
| ВАЩ |
| ВАЯ |
3. Современные квантово-химические представления о валентности
Начиная с 30-х гг. 20 в. представления о природе и характере Валентность (химич.) постоянно расширялись и углублялись, параллельно с расширением и углублением представлений о химической связи. Существенный прогресс был достигнут в 1927, когда Валентность (химич.) Гейтлер и Ф. Лондон выполнили первый количественный квантово-химический расчёт молекулы H2. В подтверждение гипотезы Льюиса было показано, что химическая связь в H2 действительно осуществляется парой электронов и является результатом электростатического (кулоновского) взаимодействия электронов и ядер. Образование молекулы из атомов энергетически выгодно, если спины электронов направлены в противоположные стороны, когда притяжение электронов к ядру (остову) чужих атомов больше энергии отталкивания между электронами и между ядрами. Параллельная ориентация спинов приводит к отталкиванию атомов друг от друга.
В дальнейшем идеи Гейтлера — Лондона были распространены на многоатомные молекулы, что привело к созданию теории локализованных пар. Согласно этой теории, общая картина распределения электронной плотности в молекулах типа MXk складывается из независимых фрагментов М — X, связь в каждом из которых осуществлена парой электронов (по одному от центрального атома М и от заместителя X), локализованной между двумя атомами М и X. Согласно этой теории Валентность (химич.) не просто связывается с наличием неспаренного электрона, но и характеризуется тем, в каком состоянии этот электрон находится (см. Атом.) или, в терминах теории химической связи, какую атомную орбиталь (АО) он занимает. АО разного типа имеют различную ориентацию в пространстве: s-орбиталь сферически симметрична, орбитали px, ру и pz вытянуты вдоль трёх взаимно перпендикулярных осей и т.д. Электроны атомов в молекулах в общем случае описываются «гибридными» (смешанными) орбиталями, в которые, в принципе, могут входить любые валентные АО в разных количественных соотношениях и у которых электронные облака сконцентрированы вдоль направлений связей М — Х значительно сильнее, чем у простых АО. Состояние валентных электронов, а следовательно и свойства Валентность (химич.) атома М, в значительной мере определяют закономерности в свойствах молекул MXk для широкого круга заместителей X. Наиболее плодотворными оказались концепции направленных Валентность (химич.) и валентных состояний атомов, позволившие объяснить и обобщить ряд закономерностей в геометрическом строении и энергиях химических связей органических и неорганических молекул.
В теории направленных валентностей предполагается, что связи М — Х в молекулах MXk тем прочнее, чем больше перекрывание электронных облаков гибридных орбиталей атомов М и X, то есть чем сильнее эти облака сконцентрированы вдоль направлений М — X. Поэтому молекулы MXk должны иметь такое геометрическое строение, при котором плотность гибридных АО вдоль направлений связей максимальна, а валентные углы Х — М — Х совпадают с углами между направлениями гибридных АО центрального атома. Например, в молекулах типа PH3 и SH2 связи осуществляются почти чистыми 3р-орбиталями центральных атомов, и поэтому PH3 и SH2 имеют пирамидальное и угловое строение с углами Н — М — Н ~ 90°. В дигалогенидах Zn, Cd, Hg, двуокисях, дисульфидах и др. соединениях углерода и его аналогов связи образуются за счёт sp-гибридных АО с валентным углом 180°, так что все молекулы типа CdCl2, Hg (CH3)2, HgI2, CS2, SiO2 и др. в парах имеют линейное строение. В случае Са, Sr, Вa, Ra и переходных металлов III—VI групп смешанная гибридизация sp + sd приводит к тому, что молекулы типа CaF2, SrF2, BaHal2, TiO2, HfO2, TaO2, ThO2, UO2 и др. имеют угловое строение.
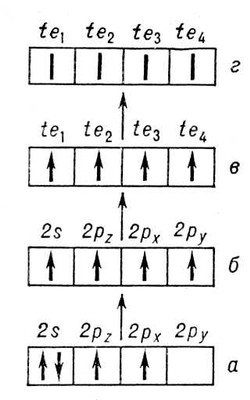
С проблемой Валентность (химич.) тесно связано приближённое понятие валентного состояния атома— гипотетического состояния, в котором находится атом в молекуле. Оно характеризуется валентной конфигурацией, то есть типом и числом заполненных и пустых валентных АО; их гибридизацией, воспроизводящей геометрическое строение ближайшего окружения рассматриваемого атома; числом электронов (в теории локализованных пар — это целое число: 2, 1 или 0), заселяющих каждую из гибридных АО, и относительной ориентацией спинов электронов. Например, в молекуле метана CH4 атом С (см. рис. 4) имеет валентную конфигурацию 2s2p3 с четырьмя тетрагональными sp3-гибридными орбиталями (te), направленными к вершинам тетраэдра, каждая из которых заселена одним электроном с неопределенно ориентированным спином, осуществляющим одну гайтлер-лондоновскую связь с соответствующим атомом Н. Как правило, валентное состояние атома в молекуле не совпадает с основным состоянием изолированного атома. Так, у углерода и его аналогов основное состояние (рис. 4, а) может быть лишь двухвалентным. У всех атомов II группы периодической системы основное состояние s2 вообще не может быть валентным, и для образования молекул типа ZnCl и ZnCl2 необходимо возбуждение s-электрона на ближайший пустой р-уровень. Энергия возбуждения валентного состояния из основного состояния для разных атомов различна и может достигать нескольких сотен ккал/моль, давая существенный вклад в общий энергетический баланс образования молекул из атомов. В случае Zn, Cd и Hg возбуждение s ®р происходит при присоединении первого атома галогена и требует значительных затрат энергии (90—120 ккал/моль), поэтому энергия разрыва связи М — Hal в двухатомных молекулах MHal значительно меньше, чем связи HalM — Hal в трёхатомных молекулах MHal2 (см. Энергия химической связи). У Ca, Sr, Вa, Ra затраты на возбуждение s ®р или s ® d значительно меньше (30—50 ккал/моль), и здесь энергии разрыва связей в молекулах галогенидов гораздо ближе друг другу.
Рис. 4. Схема возбуждения валентного состояния (г) атома углерода в молекуле типа CH4 из основного состояния (а): а — основное состояние наинизшей конфигурации 2s22p2; б — нижнее состояние валентной конфигурации 2s2p3; в— гибридизация АО; г—неопределённая ориентация спинов валентных электронов (валентное состояние).
В комплексных соединениях координационное число центрального атома часто больше числа электронов в его валентной оболочке. Важную роль здесь играют донорно-акцепторная связь и дативные связи, образующиеся за счёт неподелённой электронной пары (то есть пары электронов с противоположными спинами, занимающих одну АО) одного атома и пустой орбитали другого. Соответственно должны быть расширены и представления о Валентность (химич.): способность к образованию связей, а следовательно и Валентность (химич.) атома, обусловливается не только неспаренными электронами, но и неподелёнными парами и пустыми орбиталями валентной оболочки. Наибольшая суммарная Валентность (химич.) должна быть равна числу всех АО, составляющих валентную оболочку атома, поскольку каждая валентная АО, независимо от того, сколькими электронами она заселена у атома в валентном состоянии, потенциально способна образовать одну связь (гайтлер-лондоновскую, донорно-акцепторную или дативную). В рамках этой концепции максимальная Валентность (химич.) всех элементов второго периода от Li до F равна 4 (одна s-opбиталь + три р-орбитали), у элементов следующих периодов — 9 (за счёт ещё пяти d-opбиталей) и т.д. Решение же вопроса о том, какие из этих четырёх или девяти Валентность (химич.) насыщаются и какие остаются неиспользованными, в соединениях каждого конкретного типа определяется не только свойствами самого атома и его положением в периодической системе, но и особенностями соединения в целом. Полный ответ на него может быть получен с помощью квантово-химических расчётов. За счёт донорно-акцепторного взаимодействия фактическое число связей атома (а следовательно и его Валентность (химич.)) в комплексных и даже в простых соединениях в общем случае может быть больше не только числа его неспаренных электронов, но и числа связанных с ним соседних атомов.
Следует помнить, что подразделение связей в соединениях на гайтлер-лондоновские, донорно-акцепторные и дативные имеет, вообще говоря, лишь генетический смысл, поскольку после того как соединение образуется, в нём происходит перераспределение электронной плотности и выравнивание связей: например, в каждом из комплексных анионов типа [BF4]-, [BeF4]2-, [SiFe6] 2-, [АlF6]3-, [ZnF6]4- и др. все связи М — F совершенно одинаковы.
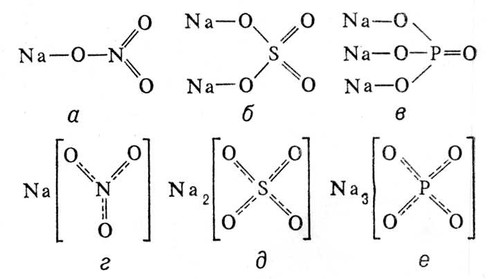
Установлено также, что в солях ион NO3- имеет структуру правильного треугольника, а ионы 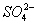 и
и 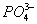 — структуру правильного тетраэдра. Поэтому строение молекул соответствующих солей точнее описывается приведёнными на рис. 5 структурными формулами г —е, а не традиционными формулами а — в, которые не учитывают реальной структуры ионов.
— структуру правильного тетраэдра. Поэтому строение молекул соответствующих солей точнее описывается приведёнными на рис. 5 структурными формулами г —е, а не традиционными формулами а — в, которые не учитывают реальной структуры ионов.
Рис. 5. Структурные формулы молекул: NaNO3 (а, г), Na2SO4 (б, д) и Na3PO4 (в, е).
Теория локализованных пар ограничена в основном несопряжёнными органическими и простыми неорганическими соединениями. Так, в случае «электронно-избыточных» молекул типа PF5, SF6, IF7, XeF6 эта теория не может объяснить осуществления высших Валентность (химич.) у атомов Р, S, I, Xe без привлечения валентных состояний с большими целочисленными заселённостями внешних d-opбиталей (sp3d для Р, sp3d3 для I, s2p3d3 для Xe и т.д.); однако энергии возбуждения последних столь велики (200—400 ккал/моль и более), что затраты на их возбуждение вряд ли могут окупиться за счёт выигрыша в энергии при образовании связей. Аналогичные трудности возникают при рассмотрении комплексных соединений, координационных кристаллов и т.д. В «электронно-дефицитных» молекулах типа В2Н6 (рис. 1, в) число связей, образуемых атомом Н, больше числа имеющихся у него валентных АО, так что связи мостиковых Н с двумя атомами В могут быть описаны только трёхцентровыми молекулярными орбиталями, охватывающими фрагменты В — Н — Валентность (химич.) В случае ароматических и сопряжённых молекул типа C5H5, C6H6, C7H7 и др., их комплексов с металлами (рис. 3) и других производных валентные 2рp-электроны в равной степени принадлежат всем атомам С и могут быть описаны лишь с помощью делокализованных молекулярных орбиталей, охватывающих всё кольцо или углеродный остов в целом. Иными словами, представления о локализованных Валентность (химич.) и связях оказались слишком узкими, чтобы вместить все известные типы соединений.
Поэтому естественным следующим шагом в развитии общей теории Валентность (химич.) стал метод молекулярных орбиталей, MO, который рассматривает молекулу как совокупность ядер и электронов, где каждый электрон движется в поле остальных электронов и всех ядер. Молекулярные орбитали, описывающие состояние электронов, в общем случае охватывают все атомы молекулы, так что каждый атом способен в принципе образовывать связи со всеми остальными атомами молекулы. Метод МО значительно более общ и последователен, что делает его в принципе пригодным для описания любых классов соединений. (См. Молекулярных орбиталей метод, Химическая связь.)
Лит.: Сыркин Я. К., Периодическая система и проблема валентности, М., 1971; Сыркин Я. К. и Дяткина М. Е., Химическая связь и строение молекул, М.—Л., 1946; Паулинг Л., Природа химической связи, пер. с англ., М. — Л., 1947; Шусторович Е. М., Новое в учении о валентности, М., 1968; Коулсон Ч., Валентность, пер. с англ., М., 1965: Маррел Д., Кеттл С., Теддер Д., Теория валентности, пер. с англ., М., 1968; Астахов К. Валентность (химич.), Современное состояние периодической системы Д. И. Менделеева, М., 1969.
О. П. Чаркин.
Под редакцией академика Я. К. Сыркина.
Валентность (от лат. valentia — сила), способность атома к образованию химических связей. Количественной мерой В. обычно принято считать число других атомов в молекуле, с которыми данный атом образует связи. В. — одно из фундаментальных понятий теории химического строения (см. Химического строения теория). Оно формировалось вместе с понятием химической связи, параллельно с развитием синтетической химии и методов исследования строения и свойств веществ, и его содержание неоднократно расширялось и изменялось по мере того, как экспериментальная химия находила всё новые и новые классы соединений с неизвестными ранее типами взаимодействия атомов в молекуле, а в последние 30—40 лет — с развитием квантовой химии. В настоящее время накопленный химией экспериментальный материал столь обширен и разнообразен, а картина химической связи в разных соединениях столь пестра, что задача нахождения последовательного, единого и всеобъемлющего определения В. представляется крайне сложной. Эти трудности побуждают некоторых химиков вообще отказаться от поисков универсального понятия В. и заменить его набором более узких, но зато более конкретных и более точных понятий (ковалентность, гетеровалентность, координационное число и т.д.), область применимости каждого из которых ограничена соединениями с каким-либо одним преобладающим типом взаимодействия (ковалентным, ионным, координационным и т.д.). Однако до настоящего времени и в специальной, и в учебной литературе В. продолжает широко использоваться и как определение способности атома к образованию связей в самом общем смысле слова, и как количественная мера этой способности, и как синоним предлагаемых более узких понятий.
Единое и последовательное определение В. следует искать в рамках квантовохимической теории молекулярных орбиталей (см. Квантовая химия, Молекулярных орбиталей метод, Химическая связь, Молекула).
Для отдельных классов соединений, где преобладает какой-либо один тип химического взаимодействия, полезную информацию о способности атомов к образованию связей могут дать перечисленные ниже частные понятия (частные определения В.).
1. Определение понятия «валентность» и связь его с другими понятиями химии2. Эволюция понятия «валентность» и его роль в истории химии
3. Современные квантово-химические представления о валентности
|
Так же Вы можете узнать о... Плая-Хирон (Playa Giron), населённый пункт в бухте Кочинос на южном берегу о. Ясберень (Jaszbereny), город в Венгрии, в медье Сольнок, на р. Ким Ок Кюн (23.2.1851, деревня Чонаммён, уезда Кванджу, провинции Чхунчхон, — 28. Сарыханов Нурмурат (1906, с. Геок-Тепе, ныне Бахарденского района Туркменской ССР, — погиб на фронте 4. Благовещенск (город в Башкирской АССР) Благовещенск, город, центр Благовещенского района Башкирской АССР. Локомоторные движения у растений, активные перемещения в водной среде, свойственные бактериям, низшим водорослям и миксомицетам, а также зооспорам и сперматозоидам. Тербий (лат. Terbium), Tb, химический элемент с атомным номером 65, атомная масса 158,9254, редкоземельный металл, относится к лантаноидам. Геральд, остров в Чукотском м., в 70 км к В. Неразрывности уравнение в гидродинамике, одно из уравнений гидродинамики, выражающее закон сохранения массы для любого объёма движущейся жидкости (газа). Хужир, посёлок городского типа в Ольхонском районе Иркутской области РСФСР. Загонная пастьба, см. в ст. Пастьба скота. Поляризационные приборы, предназначаются для обнаружения, анализа, получения и преобразования поляризованного оптического излучения (света), а также для различных исследований и измерений, основанных на явлении поляризации света. Алуксне, город, центр нского района Латвийской ССР. Коронейшен (Coronation Gulf), залив в архипелаге Канадских Арктических островов. Сортировка (сельскохозяйств.) Сортировка сельскохозяйственная, машина для разделения на фракции (сортирования) зерна зерновых культур, семян трав, овощных растений, клубней картофеля, лука-севка, плодов (например, томата, яблони) и очищения их от примесей. |
|