Сурьма
Большая Советская Энциклопедия. Статьи для написания рефератов, курсовых работ, научные статьи, биографии, очерки, аннотации, описания.
|
|
| СУА |
| СУБ |
| СУВ |
| СУГ |
| СУД |
| СУЖ |
| СУЗ |
| СУИ |
| СУЙ |
| СУК |
| СУЛ |
| СУМ |
| СУН |
| СУО |
| СУП |
| СУР |
| СУС |
| СУТ |
| СУУ |
| СУФ |
| СУХ |
| СУЧ |
| СУШ |
| СУЩ |
| СУЫ |
| СУЭ |
| СУЮ |
Сурьма (лат. Stibium), Sb, химический элемент V группы периодической системы Менделеева; атомный номер 51, атомная масса 121,75; металл серебристо-белого цвета с синеватым оттенком. В природе известны два стабильных изотопа 121Sb (57,25% ) и 123Sb (42,75% ). Из искусственно полученных радиоактивных изотопов важнейшие 122Sb (Т1/2 = 2,8 cym),124Sb (T1/2= 60,2 cym) и 125Sb (T1/2 = 2 года).
Историческая справка. Сурьма известна с глубокой древности. В странах Востока она употреблялась примерно за 3000 лет до н. э. для изготовления сосудов. В Древнем Египте уже в 19 в. до н. э. порошок сурьмяного блеска (природный Sb2S3) под названием mesten или stem применялся для чернения бровей. В Древней Греции он был известен как stími и stíbi, отсюда латинский stibium. Около 12—14 вв. н. э. появилось название antimonium. В 1789 А. Лавуазье включил Сурьма в список химических элементов под названием antimoine (современный английский antimony, испанский и итальянский antimonio, немецкий Antimon). Русская «сурьма» произошло от турецкого sürme; им обозначался порошок свинцового блеска PbS, также служивший для чернения бровей (по другим данным, «сурьма» — от персидского сурме — металл). Подробное описание свойств и способов получения Сурьма и её соединений впервые дано алхимиком Василием Валентином (Германия) в 1604.
Распространение в природе. Среднее содержание Сурьма в земной коре (кларк) 5 ×10–5 % по массе. В магме и биосфере Сурьма рассеяна. Из горячих подземных вод она концентрируется в гидротермальных месторождениях. Известны собственно сурьмяные месторождения, а также сурьмяно-ртутные, сурьмяно-свинцовые, золото-сурьмяные, сурьмяно-вольфрамовые. Из 27 минералов Сурьма главное промышленное значение имеет антимонит (Sb2S3) (см. также Сурьмяные руды). Благодаря сродству с серой Сурьма в виде примеси часто встречается в сульфидах мышьяка, висмута, никеля, свинца, ртути, серебра и других элементов.
Физические и химические свойства. Сурьма известна в кристаллической и трёх аморфных формах (взрывчатая, чёрная и жёлтая). Взрывчатая Сурьма (плотность 5,64—5,97 г/см3) взрывается при любом соприкосновении: образуется при электролизе раствора SbCl3; чёрная (плотность 5,3 г/см3) — при быстром охлаждении паров Сурьма; жёлтая — при пропускании кислорода в сжиженный SbH3. Жёлтая и чёрная Сурьма неустойчивы, при пониженных температурах переходят в обыкновенную Сурьма Наиболее устойчивая кристаллическая Сурьма (см. также Сурьма самородная), кристаллизуется в тригональной системе, а = 4,5064 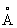 ; плотность 6,61—6,73 г/см3 (жидкой — 6,55 г/см3); tпл 630,5 °С; tкип 1635—1645 °С; удельная теплоёмкость при 20—100 °С 0,210 кдж/(кг ×К) [0,0498 кал/(г×°С)]; теплопроводность при 20 °С 17,6 вт/м × К [0,042 кал/(см ×сек × °С)]. Температурный коэффициент линейного расширения для поликристаллической Сурьма 11,5 ×10–6 при 0—100 °С; для монокристалла a1= 8,1×10–6 a2= 19,5×10–6 при 0—400 °С, удельное электросопротивление (20 °С) (43,045×10–6 ом×см). Сурьма диамагнитна, удельная магнитная восприимчивость —0,66 ×10–6. В отличие от большинства металлов, Сурьма хрупка, легко раскалывается по плоскостям спайности, истирается в порошок и не поддаётся ковке (иногда её относят к полуметаллам). Механические свойства зависят от чистоты металла. Твёрдость по Бринеллю для литого металла 325—340 Мн/м2 (32,5—34,0 кгс/мм2); модуль упругости 285—300; предел прочности 86,0 Мн/м2 (8,6 кгс/мм2). Конфигурация внешних электронов атома Sb5s25r3. В соединениях проявляет степени окисления главным образом +5, +3 и –3.
; плотность 6,61—6,73 г/см3 (жидкой — 6,55 г/см3); tпл 630,5 °С; tкип 1635—1645 °С; удельная теплоёмкость при 20—100 °С 0,210 кдж/(кг ×К) [0,0498 кал/(г×°С)]; теплопроводность при 20 °С 17,6 вт/м × К [0,042 кал/(см ×сек × °С)]. Температурный коэффициент линейного расширения для поликристаллической Сурьма 11,5 ×10–6 при 0—100 °С; для монокристалла a1= 8,1×10–6 a2= 19,5×10–6 при 0—400 °С, удельное электросопротивление (20 °С) (43,045×10–6 ом×см). Сурьма диамагнитна, удельная магнитная восприимчивость —0,66 ×10–6. В отличие от большинства металлов, Сурьма хрупка, легко раскалывается по плоскостям спайности, истирается в порошок и не поддаётся ковке (иногда её относят к полуметаллам). Механические свойства зависят от чистоты металла. Твёрдость по Бринеллю для литого металла 325—340 Мн/м2 (32,5—34,0 кгс/мм2); модуль упругости 285—300; предел прочности 86,0 Мн/м2 (8,6 кгс/мм2). Конфигурация внешних электронов атома Sb5s25r3. В соединениях проявляет степени окисления главным образом +5, +3 и –3.
В химическом отношении Сурьма малоактивна. На воздухе не окисляется вплоть до температуры плавления. С азотом и водородом не реагирует. Углерод незначительно растворяется в расплавленной Сурьма Металл активно взаимодействует с хлором и др. галогенами, образуя сурьмы галогениды. С кислородом взаимодействует при температуре выше 630 °С с образованием Sb2O3(см. Сурьмы окислы). При сплавлении с серой получаются сурьмы сульфиды, так же взаимодействует с фосфором и мышьяком. Сурьма устойчива по отношению к воде и разбавленным кислотам. Концентрированные соляная и серная кислоты медленно растворяют Сурьма с образованием хлорида SbCl3 и сульфата Sb2(SO4)3; концентрированная азотная кислота окисляет Сурьма до высшего окисла, образующегося в виде гидратированного соединения xSb2O5×уН2О. Практический интерес представляют труднорастворимые соли сурьмяной кислоты — антимонаты(МеSbO3×3H2O, где Me — Na, К) и соли не выделенной метасурьмянистой кислоты — метаантимониты (MeSbO2×ЗН2О), обладающие восстановительными свойствами. Сурьма соединяется с металлами, образуя антимониды.
Получение. Сурьма получают пирометаллургической и гидрометаллургической переработкой концентратов или руды, содержащей 20—60% Sb. К пирометаллургическим методам относятся осадительная и восстановительная плавки. Сырьём для осадительной плавки служат сульфидные концентраты; процесс основан на вытеснении Сурьма из её сульфида железом: Sb2S3 + 3Fe Û 2Sb + 3FeS. Железо вводится в шихту в виде скрапа. Плавку ведут в отражательных или в коротких вращающихся барабанных печах при 1300—1400 °Сурьма Извлечение Сурьма в черновой металл составляет более 90%. Восстановительная плавка Сурьма основана на восстановлении её окислов до металла древесным углем или каменноугольной пылью и ошлаковании пустой породы. Восстановительной плавке предшествует окислительный обжиг при 550 °С с избытком воздуха. Огарок содержит нелетучую четырёхокись Сурьма Как для осадительной, так и для восстановительной плавок возможно применение электропечей. Гидрометаллургический способ получения Сурьма состоит из двух стадий: обработки сырья щелочным сульфидным раствором с переводом Сурьма в раствор в виде солей сурьмяных кислот и сульфосолей и выделения Сурьма электролизом. Черновая Сурьма в зависимости от состава сырья и способа её получения содержит от 1,5 до 15% примесей: Fe, As, S и др. Для получения чистой Сурьма применяют пирометаллургическое или электролитическое рафинирование. При пирометаллургическом рафинировании примеси железа и меди удаляют в виде сернистых соединений, вводя в расплав Сурьма антимонит (крудум) — Sb2S3, после чего удаляют мышьяк (в виде арсената натрия) и серу при продувке воздуха под содовым шлаком. При электролитическом рафинировании с растворимым анодом черновую Сурьма очищают от железа, меди и др. металлов, остающихся в электролите (Си, Ag, Аи остаются в шламе). Электролитом служит раствор, состоящий из SbF3, H2SO4 и HF. Содержание примесей в рафинированной Сурьма не превышает 0,5—0,8%. Для получения Сурьма высокой чистоты применяют зонную плавку в атмосфере инертного газа или получают Сурьма из предварительно очищенных соединений — трёхокиси или трихлорида.
Применение. Сурьма применяется в основном в виде сплавов на основе свинца и олова для аккумуляторных пластин, кабельных оболочек, подшипников (баббит), сплавов, применяемых в полиграфии (гарт), и т. д. Такие сплавы обладают повышенной твёрдостью, износоустойчивостью, коррозионной стойкостью. В люминесцентных лампах галофосфатом кальция активируют Sb. Сурьма входит в состав полупроводниковых материалов как легирующая добавка к германию и кремнию, а также в состав антимонидов (например, InSb). Радиоактивный изотоп 12Sb применяется в источниках g-излучения и нейтронов.
О. Е. Крейн.
Сурьма в организме. Содержание Сурьма (на 100 г сухого вещества) составляет в растениях 0,006 мг, в морских животных 0,02 мг, в наземных животных 0,0006 мг. В организм животных и человека Сурьма поступает через органы дыхания или желудочно-кишечный тракт. Выделяется главным образом с фекалиями, в незначительном количестве — с мочой. Биологическая роль Сурьма неизвестна. Она избирательно концентрируется в щитовидной железе, печени, селезёнке. В эритроцитах накапливается преимущественно Сурьма в степени окисления + 3, в плазме крови — в степени окисления + 5. Предельно допустимая концентрация Сурьма 10–5 — 10–7 г на 100 г сухой ткани. При более высокой концентрации этот элемент инактивирует ряд ферментов липидного, углеводного и белкового обмена (возможно в результате блокирования сульфгидрильных групп).
В медицинской практике препараты Сурьма (солюсурьмин и др.) используют в основном для лечения лейшманиоза и некоторых гельминтозов (например, шистосоматоза).
Сурьма и её соединения ядовиты. Отравления возможны при выплавке концентрата сурьмяных руд и в производстве сплавов Сурьма При острых отравлениях — раздражение слизистых оболочек верхних дыхательных путей, глаз, а также кожи. Могут развиться дерматит, конъюнктивит и т. д. Лечение: антидоты (унитиол), мочегонные и потогонные средства и др. Профилактика: механизация производств. процессов, эффективная вентиляция и т. д.
Лит.: Шиянов А. Г., Производство сурьмы, М., 1961; Основы металлургии, т. 5, М., 1968; Исследование в области создания новой технологии производства сурьмы и ее соединений, в сборнике: Химия и технология сурьмы, Фр., 1965.
|
Так же Вы можете узнать о... Щелочные металлы, химические элементы гл. подгруппы I группы периодической системы элементов Д. Антракоз лёгких (от греч. anthrax — уголь), болезнь, связанная с осаждением в лёгких угольной пыли, один из видов пневмокониоза. Брянский машиностроительный завод (бывший паровозостроительный), один из крупнейших заводов транспортного машиностроения СССР. Геок-Тепе, посёлок городского типа, центр Геок-Тепинского района Туркменской ССР. Доростол, Дристр (лат. Durostorum, позднегреч. Кальция гидроокись, гашёная известь, пушонка, Ca (OH)2, сильное основание; бесцветные кристаллы, плотность 2,24 г/см3. Красовский Феодосий Николаевич [14(26).9.1878, Галич, ныне Костромской области, — 1. Маркелиус Свен Маркелиус (Markelius) Свен (родился 25.10.1889, Стокгольм), шведский архитектор. Низкие температуры, криогенные температуры, обычно температуры, лежащие ниже точки кипения жидкого воздуха (около 80 К). Плазменная печь, электрическая печь для нагрева, плавки и металлургической переработки металлов и сплавов, в которой источником тепла служит плазма, получаемая с помощью плазматронов. Родство в праве, кровная связь между людьми, с наличием которой закон связывает возникновение, изменение или прекращение прав и обязанностей. Спи (Spy), селение в Бельгии (провинции Намюр), близ которого в 1886 при археологических раскопках (бельг. Тэс, ийн-Гол, Тес-Хем река на С. МНР и в Тувинской АССР. Ципа, в верховье — Верхняя, в среднем течении — Нижняя, река в Бурятской АССР, левый приток р. Абрикосов Алексей Иванович [6(18).1.1875 — 9. Беднодемьяновск (до 1925 Спасск), город, центр ого района Пензенской области РСФСР. Внешнее торможение, безусловное торможение (физиологическое), подавление, ослабление условных рефлексов и безусловных рефлексов, вызванное внешним, посторонним раздражителем, например болью или неожиданным звуком. |
|