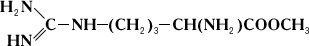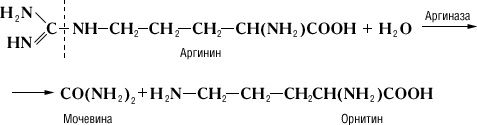Ферменты
Большая Советская Энциклопедия. Статьи для написания рефератов, курсовых работ, научные статьи, биографии, очерки, аннотации, описания.
|
|
| ФЕА |
| ФЕБ |
| ФЕВ |
| ФЕД |
| ФЕЕ |
| ФЕЙ |
| ФЕК |
| ФЕЛ |
| ФЕМ |
| ФЕН |
| ФЕО |
| ФЕР |
| ФЕС |
| ФЕТ |
| ФЕФ |
| ФЕХ |
| ФЕЦ |
Ферменты (от лат. fermentum – закваска), энзимы, специфические белковые катализаторы, присутствующие во всех живых клетках. Почти все биохимические реакции, протекающие в любом организме и в своём закономерном сочетании составляющие его обмен веществ, катализируются соответствующими Ферменты Направляя и регулируя обмен веществ, Ферменты играют важнейшую роль во всех процессах жизнедеятельности.
Рис. к ст. Ферменты.
Как всякие катализаторы, Ферменты снижают энергию активации, необходимую для осуществления той или иной химической реакции, направляя её обходным путём – через промежуточные реакции, которые требуют значительно меньшей энергии активации. Так, реакция АБ ® А + Б в присутствии Ферменты идёт следующим образом: АБ + Ф ® АБФ и далее АБФ ® БФ + А и БФ ® Б + Ферменты Например, для осуществления реакции гидролиза дисахарида сахарозы, в результате которого образуются глюкоза и фруктоза, без участия катализатора требуется 32 000 кал (1 кал = 4,19 дж) на моль сахарозы. Если же реакция катализируется Ферменты b-фруктофуранозидазой, то необходимая энергия активации составляет всего 9400 кал. Подобное понижение энергии активации под влиянием Ферменты – следствие перераспределения электронных плотностей и некоторой деформации молекул субстрата, происходящей при образовании промежуточного соединения – фермент-субстратного комплекса (АБФ). Эта деформация, ослабляя внутримолекулярные связи, приводит к понижению необходимой энергии активации и, следовательно, ускоряет течение реакции (см. Катализ, Ферментативный катализ).
Рис. к ст. Ферменты.
История изучения ферментов. В 1814 рус. химик К. Г. С. Кирхгоф открыл ферментативное действие водных вытяжек из проросшего ячменя, расщеплявших крахмал до сахара. Можно считать, что эти работы положили начало энзимологии (ферментологии) как самостоятельному разделу биологической химии. В 1833 французскими химиками А. Пайеном и Ж. Персо впервые был выделен из солода препарат фермента амилазы, что способствовало развитию препаративной химии Ферменты В середины 19 в. разгорелась дискуссия о природе брожения между Л. Пастером, с одной стороны, и Ю. Либихом, П. Э. М. Бертло и К. Бернаром – с другой. Опираясь на свои классические работы, Пастер развивал представление о том, что брожение вызывается лишь живыми микроорганизмами и что процесс брожения неразрывно связан с их жизнедеятельностью. Либих и его сторонники, отстаивая химическую природу брожения, считали, что оно является следствием образования в клетках микроорганизмов растворимых Ферменты, подобных выделяемой из солода амилазе. Однако все попытки выделить из разрушенных дрожжевых клеток растворимый Ферменты, способный вызвать брожение, не удавались. Дискуссия Либиха и Пастера о природе брожения была разрешена в 1897 Э. Бухнером, который, растирая дрожжи с инфузорной землёй, выделил из них бесклеточный растворимый ферментный препарат (названный им зимазой), вызывавший спиртовое брожение. Открытие Бухнера утвердило материалистическое понимание природы брожений и имело большое значение для дальнейшего развития как энзимологии, так и всей биохимии.
В начале 20 в. Р. Вильштеттер с сотрудниками стал широко применять для выделения и очистки Ферменты метод адсорбции (впервые предложен А. Я. Данилевским для разделения Ферменты поджелудочной железы). Работы Вильштеттера, имевшие большое значение для характеристики свойств отдельных Ферменты, привели вместе с тем к принципиально неправильному выводу, что Ферменты не принадлежат ни к одному из известных классов органических соединений. Выдающимся успехом в выяснении химической природы Ферменты были исследования американских биохимиков Дж. Самнера, выделившего в 1926 в кристаллическом виде Ферменты уреазу из семян канавалии, и Дж. Нортропа, получившего в 1930 кристаллы протеолитического Ферменты пепсина. Работы Самнера и Нортропа указали путь получения высокоочищенных кристаллических препаратов Ферменты и вместе с тем неопровержимо доказали белковую природу Ферменты
С середине 20 в. благодаря развитию методов физико-химического анализа (главным образом хроматографии) и методов белковой химии расшифрована первичная структура многих Ферменты Так, работами американских биохимиков С. Мура, У. Стайна и К. Анфинсена показано, что Ферменты рибонуклеаза из поджелудочной железы быка представляет собой полипептидную цепочку, состоящую из 124 аминокислотных остатков, соединённых в 4 местах дисульфидными связями.
Первичная структура (последовательность аминокислотных остатков) фермента рибонуклеазы из поджелудочной железы быка. Чёрным обозначены 4 дисульфидных мостика, скрепляющих полипептидную цепь фермента.
С помощью рентгеноструктурного анализа расшифрована вторичная и третичная структура ряда Ферменты Так, методом рентгеноструктурного анализа английский учёный Д. Филлипс в 1965 установил трёхмерную структуру Ферменты лизоцима. Показано, что многие Ферменты обладают также четвертичной структурой, т. е. их молекула состоит из нескольких идентичных или различных по составу и структуре белковых субъединиц (см. Биополимеры).
Общая характеристика ферментов. Все Ферменты разделяются на две большие группы: однокомпонентные, состоящие исключительно из белка, и двухкомпонентные, состоящие из белка, называемого апоферментом, и небелковой части, называемой простетической группой. Апофермент двухкомпонентных Ферменты называют также белковым носителем, а простетическую группу – активной группой. Благодаря работам О. Варбурга, А. Теорелля, Ферменты Линена, Ферменты Липмана и Л. Лелуара установлено, что простетические группы многих Ферменты представляют собой производные витаминов или нуклеотидов. Т. о. была открыта важнейшая функциональная связь между Ферменты, витаминами и нуклеотидами, являющимися строительными «кирпичиками» нуклеиновых кислот.
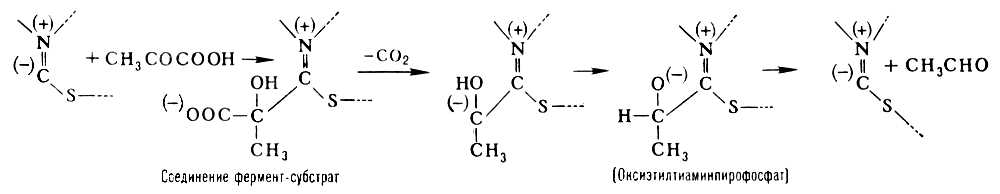
Примером двухкомпонентного Ферменты является пируватдекарбоксилаза, катализирующая расщепление пировиноградной кислоты на двуокись углерода и уксусный альдегид: CH3COCOOH ® CH3CHO + CO2. Простетическая группа пируватдекарбоксилазы (тиаминнирофосфат) образована молекулой тиамина (витамина B1) и двумя остатками фосфорной кислоты. Простетические группы ряда важных окислительно-восстановительных Ферменты – дегидрогеназ содержат производное амида никотиновой кислоты (ниацина), или же рибофлавина (витамина B2); в состав простетических группы т. н. пиридоксалевых ферментов, катализирующих перенос аминогрупп (–NH2) и декарбоксилирование и ряд др. превращений аминокислот, входит пиридоксальфосфат – производное витамина B6; активная группа Ферменты, катализирующих перенос остатков различных органических кислот (например, ацетила CH3CO–), включает витамин пантотеновую кислоту. К двухкомпонентным Ферменты относятся также важные окислительные Ферменты – каталаза (катализирует реакцию разложения перекиси водорода на воду и кислород) и пероксидаза (окисляет перекисями различные соединения, например полифенолы с образованием соответствующего хинона и воды). Каталитическое действие этих Ферменты может быть воспроизведено с помощью ионов трёхвалентного железа. Эти ионы обладают, однако, очень малой каталитической активностью, которая может быть усилена, если атом железа входит в состав гема. Хотя гем обладает уже значительным каталазным действием, его каталитическая активность всё же в несколько миллионов раз меньше активности каталазы, в которой гем в качестве простетической группы этого Ферменты связан со специфическ им белком. Гем обладает также слабым пероксидазным действием, однако это действие проявляется в полной мере только после соединения гема со специфическим белком в целостный Ферменты пероксидазу. Т. о., соединение простетической группы с белком приводит к резкому возрастанию её каталитической активности. Вместе с тем от природы белка зависит не только каталитическая активность, но и специфичность действия Ферменты Прочность связи простетической группы и апофермента различна у разных Ферменты У некоторых Ферменты, например у дегидрогеназ, катализирующих окисление различных субстратов путём отщепления водорода, эта связь является непрочной. Такие Ферменты легко диссоциируют (например, при диализе) и распадаются на простетическую группу и апофермент. Простетические группы, легко отделяющиеся от белковой части Ферменты, называются коферментами.
Многие Ферменты содержат металлы, без которых Ферменты не активен. Эти металлы называются кофакторам и. Так, пероксидаза и каталаза содержат железо, аскорбинатоксидаза, катализирующая окисление аскорбиновой кислоты, – медь, алкогольдегидрогеназа, окисляющая спирты в соответствующие альдегиды, – цинк.
Специфичность и механизм действия ферментов. Действие Ферменты, в отличие от неорганических катализаторов, строго специфично и зависит от строения субстрата, на который Ферменты действует. Прекрасным примером такой зависимости служит катализируемая аргиназой реакция гидролитического расщепления аминокислоты аргинина на орнитин и мочевину:
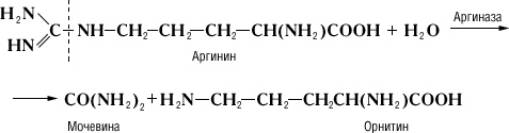 Однако аргиназа не расщепляет метилового эфира аргинина:
Однако аргиназа не расщепляет метилового эфира аргинина: 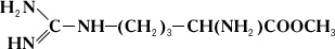
Дипептид, состоящий из остатков двух молекул аргинина, под действием аргиназы даёт лишь половину теоретического количества мочевины. Очевидно, что, хотя расщепление аргинина происходит в месте, весьма отдалённом от карбоксильной (COOH) группы (показано пунктиром), необходимым условием действия аргиназы является её соединение с карбоксильной группой аргинина. Поэтому замещение водорода в карбоксильной группе на метильный остаток или же связывание карбоксильной группы со второй молекулой аргинина оказывают резкое влияние на действие аргиназы. Примеры специфичности действия Ферменты могут быть приведены при рассмотрении их стереохимической специфичности, т. е. действия Ферменты на стереоизомеры (см. Изомерия). Так, Ферменты, окисляющий природные L-аминокислоты, не действует на D-изомеры этих же аминокислот; Ферменты дипептидаза, гидролизирующий дипептиды, состоящие из остатков L-аминокислот, не действует на такие же дипептиды, состоящие из остатков D-аминокислот. Специфичность действия Ферменты послужила нем. учёному Э. Фишеру основанием для сравнения субстрата и Ферменты, который катализирует его превращение, с замком и соответствующим ему ключом. Стереохимическая специфичность Ферменты теснейшим образом связана с одной из основных особенностей живых организмов – их способностью к синтезу оптически активных органических соединений.
В образовании соединения между ферментом и субстратом – т. н. фермент-субстратного комплекса – принимают участие лишь некоторые функциональные группы молекулы Ферменты, образующие его активный центр. Так, например, в молекуле гидролизирующего белки химотрипсина, состоящего из 246 аминокислотных остатков, активный центр образован одним из остатков серина (химотрипсин относится к сериновым протеиназам) и двумя остатками гистидина, расположенными в удалённых друг от друга участках полипептидной цепи. Сближение этих функциональных групп активного центра происходит благодаря свойственной молекуле химотрипсина специфической пространственной (третичной) структуре. Её нарушение в результате денатурации белка или каких-либо химических модификаций приводит к изменению или полной потере каталитической активности. В случае двухкомпонентных Ферменты в образовании фермент-субстратного комплекса принимают участие не только функциональные группы апофермента, но и простетическая группа. Так, при расщеплении пировиноградной кислоты пируватдекарбоксилазой субстрат связывается с частью молекулы тиамин-пирофосфата следующим образом: 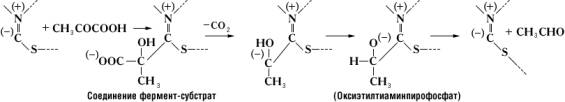
Исключительно высокая специфичность действия Ферменты объясняется их белковой природой. Так, пиридоксалевые Ферменты, содержащие один и тот же кофермент (пиридоксальфосфат), могут принадлежать к различным классам и катализировать самые разнообразные реакции. Специфичность их действия зависит от природы апофермента.
Условия действия ферментов. Действие Ферменты зависит от ряда факторов, прежде всего от температуры и реакции среды (pH). Оптимальная температура, при которой активность Ферменты наиболее высока, находится обычно в пределах 40–50 °С. При более низких температурах скорость ферментативной реакции, как правило, снижается, а при температурах, близких к 0 °С, практически реакция полностью прекращается. При повышении температуры выше оптимальной скорость ферментативной реакции также снижается и, наконец, полностью прекращается. Снижение интенсивности действия Ферменты при повышении температуры сверх оптимальной объясняется главным образом начинающимся разрушением (денатурацией) входящего в состав Ферменты белка. Поскольку белки в сухом состоянии денатурируются значительно медленнее, чем белки оводнённые (в виде белкового геля или раствора), инактивирование Ферменты в сухом состоянии происходит гораздо медленнее, чем в присутствии влаги. Поэтому сухие споры бактерий или сухие семена могут выдержать нагревание до гораздо более высоких температур, чем те же споры или семена в увлажнённом состоянии.
Важнейшим фактором, от которого зависит действие Ферменты, как установил впервые С. Сёренсен, является активная реакция среды – pH. Отдельные Ферменты различаются по оптимальной для их действия величине pH. Так, например, пепсин, содержащийся в желудочном соке, наиболее активен в сильнокислой среде (pH 1–2); трипсин – протеолитический Ферменты, выделяемый поджелудочной железой, имеет оптимум действия в слабощелочной среде (pH 8–9); оптимум действия папаина – протеолитического Ферменты растительного происхождения – находится в слабокислой среде (pH 5–6).
Действие Ферменты зависит также от присутствия специфических активаторов и неспецифических или специфических ингибиторов. Так, энтерокиназа, выделяемая поджелудочной железой, превращает неактивный трипсиноген в активный трипсин. Подобные неактивные Ферменты, содержащиеся в клетках и в секретах различных желёз, называются проферментами. Многие Ферменты активируются в присутствии соединений, содержащих сульфгидрильную группу (–SH). К ним принадлежат аминокислота цистеин и трипептид глутатион, содержащийся в каждой живой клетке. Особенно сильное активирующее действие глутатион оказывает на некоторые протеолитические и окислительные Ферменты Неспецифическое угнетение (ингибирование) Ферменты происходит под действием различных веществ, дающих с белками нерастворимые осадки или блокирующих в них какие-либо группы (например, SH-группы). Существуют более специфические ингибиторы Ферменты, угнетение которыми каталитических функций основано на специфическом связывании этих ингибиторов с определёнными химическими группировками в активном центре Ферменты Так, окись углерода (CO) специфически ингибирует ряд окислительных Ферменты, содержащих в активном центре железо или медь. Вступая в химическое соединение с этими металлами, она блокирует активный центр Ферменты и вследствие этого он теряет свою активность. Различают обратимое и необратимое ингибирование Ферменты В случае обратимого ингибирования (например, действие малоновой кислоты на сукцинатдегидрогеназу) активность Ферменты восстанавливается при удалении ингибитора диализом или иным способом. При необратимом ингибировании действие ингибитора, даже при очень низких его концентрациях, усиливается со временем и в конце концов наступает полное торможение активности Ферменты Ингибирование Ферменты может быть конкурентным и неконкурентным. При конкурентном ингибировании ингибитор и субстрат конкурируют между собой, стремясь вытеснить один другого из фермент-субстратного комплекса. Действие конкурентного ингибитора снимается высокими концентрациями субстрата, в то время как действие неконкурентного ингибитора в этих условиях сохраняется. Действие на Ферменты специфических активаторов и ингибиторов имеет большое значение для регулирования ферментативных процессов в организме.
Классификация и номенклатура ферментов. По рекомендации Международного биохимического союза, Ферменты разделяют на 6 классов: 1) оксидоредуктазы, 2) трансферазы, 3) гидролазы, 4) лиазы, 5) изомеразы, 6) лигазы. Рекомендована следующая нумерация Ферменты Шифр (индекс) каждого Ферменты содержит 4 числа, разделённых точками. Первая цифра указывает класс, вторая – подкласс, третья – подподкласс, четвёртая – порядковый номер в данном подподклассе. Так, Ферменты аргиназа, расщепляющий аргинин на орнитин и мочевину, имеет шифр 3.5.3.1, т. е. относится к классу гидролаз, подклассу Ферменты, действующих на непептидные С–N-cвязи, и подподклассу Ферменты, расщепляющих эти связи в линейных (не циклических) соединениях.
Класс оксидоредуктаз включает Ферменты, катализирующие окислительно-восстановительные реакции, и разделяется на 14 подклассов в зависимости от природы той группы в молекуле субстрата, которая подвергается окислению (спиртовая, альдегидная, кетонная и т.д.). Подподклассы оксидоредуктаз индексируются в зависимости от типа участвующего в реакции акцептора водорода (электронов) – кофермента, цитохрома, молекулярного кислорода и т.д. Т. о., первые три цифры шифра определяют тип Ферменты, так, например, 1.2.3 обозначают оксидоредуктазу, действующую на альдегид с молекулярным кислородом в качестве акцептора электронов. Класс трансфераз, объединяющий Ферменты, катализирующие реакции переноса групп, подразделяется на 8 подклассов в зависимости от природы переносимых групп, которыми могут быть одноуглеродные или гликозильные остатки, азотистые или содержащие серу группы и т.д. У трансфераз третья цифра характеризует тип переносимых групп (например, одноуглеродная группа может быть метилом, карбоксилом, формилом и т.д.). К гидролазам принадлежат Ферменты, катализирующие гидролитическое расщепление различных соединений; разделяются на 9 подклассов в зависимости от типа гидролизуемой связи – сложноэфирной, пептидной, гликозидной и т.д. Третья цифра у гидролаз уточняет тип гидролизуемой связи. Лиазы – Ферменты, отщепляющие от субстрата ту или иную группу (негидролитическими путями) с образованием двойной связи или, наоборот, присоединяющие группы к двойным связям. У лиаз 5 подклассов, вторая цифра шифра обозначает тип подвергающейся разрыву связи (углерод – углерод, углерод – кислород и т.д.), а третья – тип отщепляемой группы. Изомеразы, катализирующие реакции изомеризации, разделяются на 5 подклассов в зависимости от типа катализируемой реакции; третья цифра шифра детализирует характер превращения субстрата. Лигазами (или синтетазами) называются Ферменты, которые катализируют соединение двух молекул, сопряжённое с расщеплением пирофосфатной связи в молекуле аденозинтрифосфорной кислоты (АТФ) или аналогичного трифосфата. Первая цифра шифра лигаз обозначает тип вновь образуемой связи (углерод – азот, углерод – кислород и т.д.), а вторая – природу образующегося соединения.
Классификация и номенклатура Ферменты, кроме шифра, включает также систематические и тривиальные (рабочие) названия. Так, например, систематическое название карбоксилаза 2-оксокислот соответствует уже упоминавшемуся тривиальному название пируватдекарбоксилаза, а систематическое название L-apгинин – амидиногидролаза – рабочему название аргиназа.
Регуляция ферментативных процессов. Действие Ферменты в организме осуществляется путём регуляции их синтеза и активности. Свойственный данному организму набор Ферменты определяется его генетической природой. Однако он может изменяться под влиянием различных внутренних и внешних факторов – мутаций, действия ионизирующей радиации, состава газовой среды, условий питания и т.д. Так, в результате мутаций возникают т. н. «молекулярные болезни» (например, алкаптонурия). При этом наследственном заболевании у больных с мочой выделяется гомогентизиновая кислота, образующаяся в результате превращений аминокислоты тирозина. Гомогентизиновая кислота накапливается в организме и выделяется с мочой вследствие того, что у больных алкаптонурией утеряна способность к синтезу двух Ферменты, катализирующих её дальнейшее окисление, – параоксифенилпируватоксидазы и оксидазы гомогентизиновой кислоты. Влияние условий питания организма на его ферментный аппарат особенно наглядно прослеживается у микроорганизмов. Например, кишечная палочка при росте на питательной среде, содержащей глюкозу, синтезирует только следы b-галактозидазы. В присутствии же различных b-галактозидов образуются значительные количества этого Ферменты – до 6–7% от всех содержащихся в клетке белков. Ферменты, новообразование или усиление синтеза которых происходит под влиянием какого-либо соединения, называются индуцируемыми ферментами. Под влиянием др. соединений может происходить подавление синтеза Ферменты, называемое репрессией. В животном организме индукция и репрессия синтеза Ферменты осуществляется не только под влиянием соответствующих субстратов и метаболитов, но и под влиянием гормонов. Так, синтез глюкозо-6-фосфатазы, принимающей участие в синтезе глюкозы в печени, индуцируется гормонами тироксином и кортизоном, но репрессируется инсулином. Общая теория индукции и репрессии биосинтеза на генетическом уровне дана французскими учёными Ферменты Жакобом и Ж. Моно (см. Оперон). В одном организме один и тот же Ферменты может быть представлен различными молекулярными формами. Такие разнообразные формы Ферменты, катализирующие одну и ту же реакцию, но различающиеся по физическим, химическим и иммунологическим свойствам, называются изоферментами. Синтез изоферментов определяется генетическими факторами, но может изменяться под влиянием условий существования организма. Т. о., факторы, от которых зависят концентрация и активность Ферменты в организме, так же разнообразны, как и условия его существования. Это прежде всего водный, газовый, температурный, кислотный и световой режим среды, а также концентрация субстратов и различных кофакторов, необходимых для действия Ферменты, наличие активаторов и ингибиторов, концентрации метаболитов и, наконец, у высших многоклеточных организмов это нервная и гормональная регуляция ферментативной активности.
Примером влияния условий существования организма на активность Ферменты может служить Пастера эффект – прекращение брожения под действием кислорода. Активность многих Ферменты регулируется по аллостерическому принципу. У таких Ферменты имеется т. н. аллостерический центр, присоединяясь к которому определённый метаболит – эффектор вызывает изменение структуры активного центра, вследствие чего активность Ферменты снижается или повышается.
Некоторые Ферменты находятся в клетке в виде многоферментных комплексов. В таких многоферментных ансамблях активность каждого отдельного Ферменты строго координирована и регулируется др. Ферменты, входящими в состав данного комплекса. Примером многоферментного комплекса может служить пируватдегидрогеназа, состоящая из 16 молекул пируватдекарбоксилазы, 8 молекул дигидролипоилдегидрогеназы и 4 агрегатов липоатацетилтрансферазы, каждая из которых состоит из 16 субъединиц. Решающую роль в регуляции активности Ферменты в клетке играют различные субклеточные структуры – митохондрии, микросомы, лизосомы и т.д., и белковолипидные мембраны, отделяющие их от цитоплазмы. Многие Ферменты вмонтированы в этих мембранах в виде многоферментных ансамблей.
Практическое значение ферментов. Ферментативные процессы являются основой многих производств: хлебопечения, виноделия, пивоварения, сыроделия, производства спирта, чая, уксуса. С начала 20 в. по предложению япон. учёного Д. Такамине в спиртовой и др. отраслях промышленности началось применение ферментных препаратов, получаемых из плесневых грибов или бактерий. В ряде стран этот способ широко используется для осахаривания с помощью амилаз крахмалистого сырья с целью получения кристаллической глюкозы или его сбраживания на спирт. Концентрированные амилолитические препараты Ферменты из плесневых грибов при добавке в тесто приводят к улучшению качества хлеба и ускорению технологического процесса. Препараты протеолитических Ферменты, получаемых из микроорганизмов, употребляются в кожевенной промышленности для удаления волос и мягчения сырья, а в сыродельной промышленности – для замены дефицитного сычужного фермента (реннина). Препараты микробных пектолитических Ферменты широко используют при производстве соков (выход плодового сока повышается на 10–20%). Всё большее применение очищенные ферментные препараты находят в медицине. В научных исследованиях и в клинической практике высокоочищенные ферментные препараты служат в качестве специфических средств биохимического анализа (см. Ферментативные методы анализа). Весьма перспективно применение т. н. иммобилизованных Ферменты, которые связываются каким-либо носителем, образующим с данным Ферменты нерастворимый комплекс. При подборе соответствующего носителя можно получить иммобилизованный Ферменты с высокой активностью, устойчивый по отношению к денатурирующим агентам. Колонка, заполненная иммобилизованным Ферменты, может быть многократно использована для проведения соответствующей реакции. Иммобилизованные Ферменты находят всё более широкое применение в аналитической практике и биохимической технологии.
Лит.: Ферменты, М., 1964; Диксон М., Уэбб Э., Ферменты, пер. с англ., М., 1966; Номенклатура ферментов, пер. с англ., М., 1966; Бернхард С., Структура и функция ферментов, пер. с англ., М., 1971; Структура и функция ферментов, в. 1–2, М., 1972–73; Фениксова Р. В., Биохимические основы получения и применения ферментных препаратов, в кн.: Техническая биохимия, М., 1973; Кретович В. Л., Введение в энзимологию, 2 изд., М,, 1974; Аллостерические ферменты, М., 1975; Ферменты медицинского назначения, Л., 1975; Ферментные препараты в пищевой промышленности, М., 1975; Advances in enzymology and related areas of molecular biology, v. 1–43, N. Y., 1941–75; Methods in enzymology, v. 1–36, N. Y., 1955–75.
Рис. к ст. Ферменты.
|
Так же Вы можете узнать о... Рейсмусовый станок ,деревообрабатывающий станок для плоского фрезерования (простругивания) досок, брусьев или щитов в размер по толщине. Теология (греч. theologia, от theos — бог и logos — слово, учение), богословие, совокупность религиозных доктрин о сущности и действии бога, построенная в формах идеалистического умозрения на основе текстов, принимаемых как божественное откровение. Шахджаханпур, город в Северной Индии, в штате Уттар-Прадеш. Бедекер, название широко распространённых путеводителей по различным странам для путешественников и туристов, содержащих обширный фактический материал (на немецком и других языках). Голдсмит Оливер Голдсмит (Goldsmith) Оливер (10.11.1728, дер. «Казах адебиети» («Казак  Логарифмическая функция, функция, обратная к показательной функции. Логарифмическая функция, функция, обратная к показательной функции.Ончул Димитрие Ончул (Onciul) Димитрие [26.10(7.11).1856, село Стража, уезд Рэдэуци, — 20. Рудабанья (Rudabanya), посёлок на С. Венгрии, в медье Боршод-Абауй-Земплен. Торренс Роберт Торренс (Torrens) Роберт (1780, Ирландия, — 27. Щитовая выемка, способ добычи полезного ископаемого, при котором разрушение его производится механическими средствами или с помощью буровзрывных работ под специальным щитовым перекрытием. Биркет-Смит Кай Биркет-Смит (Birket-Smith) Кай (р. 20.1.1893, Копенгаген), датский этнограф и археолог, исследователь культуры и быта эскимосов и индейцев американского Севера. Громов Игнатий Владимирович Громов (Мамонов) Игнатий Владимирович [29.1(10. Каркинитский залив, залив Чёрного моря между северо-западным берегом Крымского полуострова и берегом материка. Мак-Клур Роберт Джон Мак-Клур (McClure) Роберт Джон (28.1.1807, Уэксфорд, Ирландия, — 17. Пальма (город в Испании) Пальма (Palma), город и порт в Испании, на юго-западном побережье острова Мальорка (Балеарские острова). Светлая, посёлок городского типа в Тернейском районе Приморского края РСФСР. |
|