Азота окислы
Большая Советская Энциклопедия. Статьи для написания рефератов, курсовых работ, научные статьи, биографии, очерки, аннотации, описания.
|
|
| АЗА |
| АЗБ |
| АЗГ |
| АЗД |
| АЗЕ |
| АЗИ |
| АЗН |
| АЗО |
| АЗП |
| АЗУ |
| АЗХ |
Азота окислы, соединения азота с кислородом. Известны N2O, NO, N2O3, NO2 (и его димер N2O4), N2O5; есть сведения о существовании NO3, не выделенного в свободном состоянии. При высокой температуре в пламени вольтовой дуги, а в природе — при электроразряде из смеси азота с кислородом образуется окись азота NO, которая при охлаждении переходит в NO2. Другие Азота окислы получают косвенным путём. N2O5 — твёрдое вещество; остальные окислы при обычных условиях газообразны.
Закись азота N2O — бесцветный газ со слабым приятным запахом и сладковатым вкусом; вдыхание смеси воздуха с N2O вызывает состояние, напоминающее опьянение (отсюда название — веселящий газ). Плотность при 0°С и 101 325 н/м2(760 мм рт. ст.) 1,9804 кг/м3, tкип — 89,5°С, tпл — 102,4°С. 1 объём N2O при 5°C растворяет 1,048 объёма N2O. Химически N2O с водой, растворами кислот и щелочей не реагирует, кислородом не окисляется. Выше 500°C разлагается: 2N2O = 2N2 + O2; поэтому при повышенных температурах действует как сильный окислитель и поддерживает горение. Получают N2O термическим разложением нитрата аммония: NH4NO3=N2O+ 2H2O. В медицине служит для общей анестезии.
Окись азота NO — бесцветный газ, буреющий при соприкосновении с воздухом вследствие окисления до NO2. Плотность при 0°С и 101 325 н/м2(760 мм рт ст) 1,3402 кг/м3, tкип—151,8°С, tпл—163,6°С. В воде мало растворима (0,0738 объёма в 1 объёме H2O при 0°С). С водой, кислотами и щелочами химически не взаимодействует. Образует многочисленные продукты присоединения, например нитрозилхлорид NOCI. Получают NO действием разбавленной азотной кислоты на некоторые металлы, например: 3Cu + 8HNO3= 3Cu(NO3)2 + 4H2O + 2NO. Окись азота — важный полупродукт окисления аммиака при получении азотной кислоты.
Азотистый ангидрид (трёхокись азота) N2O3 — в обычных условиях неустойчивое соединение. Разлагается уже при 0°С:
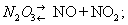
Около 3,5°С кипит с разложением, при 25°C содержит только 10% недиссоциированного N2O3. При низкой температуре может быть получен в виде тёмно-голубой жидкости, при сильном охлаждении — светло-голубой массы с tпл —102°С. С водой образует азотистую кислоту: N2O3 + H2O = 2HNO2, со щелочами — соли (см. Нитриты). N2O3 получают по реакции: N2O4+ 2NO = 2N2O3; практического применения не находит.
Двуокись азота NO2 — бурый газ с удушливым запахом, при 21,15°C — буро-красная жидкость, бледнеющая при дальнейшем охлаждении из-за образования четырёхокиси азота N2O4 , tотв—11,2°С. Взаимодействует с водой с образованием азотной кислоты и окиси азота: 3NO2 + H2O = 2HNO3 + NO; со щелочами образует нитраты и нитриты. Двуокись азота — сильный окислитель; в токе NO2 энергично сгорают уголь, сера, фосфор, органические соединения. В промышленности NO2 получают окислением NO при производстве азотной кислоты, в лаборатории — термическим разложением некоторых нитратов: 2Pb(NO3)2 = 2PbO + O2 + 4NO2. Применяют NO2 как нитрующий агент (см. Нитрование органических соединений).
Азотный ангидрид (пятиокись азота) N2O5 — бесцветные очень летучие кристаллы. Крайне неустойчив и взрывоопасен. Взаимодействует с водой, давая азотную кислоту: N2O5 +Н2O = 2HNO3, со щелочами образует соли — нитраты. В лаборатории получают по реакции: 2HNO3 + P2O5 = N2O5+ 2HPO3. Практического применения не находит. Все Азота окислы физиологически активны.
Лит. см. при ст. Азот, Азотная кислота.
|
Так же Вы можете узнать о... Демографическая статистика, статистика населения, область статистики, занимающаяся приложением статистических методов к сбору, обработке, изложению и анализу данных, характеризующих численность, состав, размещение и движение населения той или иной страны, территории или отдельных его групп. Иностранных языков педагогические институты, готовят преподавателей иностранных языков (английский, немецкий, французский, испанский и др. Констанций (в Древнем Риме) Констанций (Constantius). В Древнем Риме: Лючжоу, город в Южном Китае, в Гуанси-Чжуанском автономном районе, на реке Люцзян — притоке реки Сицзян. Насадка в химической технологии, тела различной формы и размера, служащие для заполнения рабочего пространства аппаратов — абсорберов, ректификационных колонн и др. Пермяков Яков (г. рождения неизвестен — умер 1712), русский мореход и промышленник. Ренар Жюль Ренар (Renard) Жюль (22. |
|