Кадмий
Большая Советская Энциклопедия. Статьи для написания рефератов, курсовых работ, научные статьи, биографии, очерки, аннотации, описания.
|
|
| КАА |
| КАБ |
| КАВ |
| КАГ |
| КАД |
| КАЕ |
| КАЖ |
| КАЗ |
| КАИ |
| КАЙ |
| КАК |
| КАЛ |
| КАМ |
| КАН |
| КАО |
| КАП |
| КАР |
| КАС |
| КАТ |
| КАУ |
| КАФ |
| КАХ |
| КАЦ |
| КАЧ |
| КАШ |
| КАЩ |
| КАЭ |
| КАЮ |
| КАЯ |
Кадмий (Cadmium), Cd, химический элемент II группы периодической системы Менделеева; атомный номер 48, атомная масса 112,40; белый, блестящий, тяжёлый, мягкий, тягучий металл. Элемент состоит из смеси 8 стабильных изотопов с массовыми числами: 106 (1,215%), 108 (0,875%), 110 (12,39%), 111 (12,75%), 112 (24,07%), 113 (12,26%), 114 (28,86%), 116 (7,58%).
Историческая справка. В 1817 нем. химик Ф. Штромейер, при ревизии одной из аптек, обнаружил, что имевшийся там карбонат цинка содержит примесь неизвестного металла, который осаждается в виде жёлтого сульфида сероводородом из кислого раствора. Штромейер назвал открытый им металл кадмием (от греч. kadméia — нечистая окись цинка, также цинковая руда). Независимо от него нем. учёные Кадмий Герман, Кадмий Карстен и В. Мейснер в 1818 открыли Кадмий в силезских цинковых рудах.
Распространение в природе. Кадмий — редкий и рассеянный элемент с кларком литосферы 1,3×10-5 % по массе. Для Кадмий характерны миграция в горячих подземных водах вместе с цинком и др. халькофильными элементами и концентрация в гидротермальных месторождениях. Минерал сфелерит ZnS местами содержит до 0,5—1% Cd, максимально до 5%. Реже встречается гринокит CdS. Концентрируется кадмий в морских осадочных породах — сланцах (Мансфельд, ГДР), в песчаниках, в которых он также связан с цинком и др. халькофильными элементами. В биосфере известны 3 очень редких самостоятельных минерала Кадмий — карбонат CdCO3 (отавит), окись CdO (монтепонит) и селенид CdSe.
Физические и химические свойства. Кристаллическая решётка Кадмий гексагональная, а = 2,97311 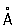 , с = 5,60694
, с = 5,60694  (при 25 °С); атомный радиус 1,56
(при 25 °С); атомный радиус 1,56 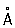 , ионный радиус Cd2+ 1,03
, ионный радиус Cd2+ 1,03 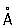 . Плотность 8,65 г/см3 (20 °С), tпл 320,9° С, tkип 767 °С, коэффициент термического расширения 29,8×10-6 (при 25 °С); теплопроводность (при 0 °C) 97,55 вт/(м×К) или 0.233 кал/(см×сек°С); удельная теплоёмкость (при 25 °С) 225,02 дж/(кг×К) или 0,055 кал/(г×°С); удельное электросопротивление (при 20°C) 7,4×10-8ом×м (7,4×10-6ом×см); температурный коэффициент электросопротивления 4,3×10-3 (0—100 °С). Предел прочности при растяжении 64 Мн/м2(6,4 кгс/мм2), относительное удлинение 20%, твёрдость по Бринеллю 160 Мн/м2 (16 кгс/мм2).
. Плотность 8,65 г/см3 (20 °С), tпл 320,9° С, tkип 767 °С, коэффициент термического расширения 29,8×10-6 (при 25 °С); теплопроводность (при 0 °C) 97,55 вт/(м×К) или 0.233 кал/(см×сек°С); удельная теплоёмкость (при 25 °С) 225,02 дж/(кг×К) или 0,055 кал/(г×°С); удельное электросопротивление (при 20°C) 7,4×10-8ом×м (7,4×10-6ом×см); температурный коэффициент электросопротивления 4,3×10-3 (0—100 °С). Предел прочности при растяжении 64 Мн/м2(6,4 кгс/мм2), относительное удлинение 20%, твёрдость по Бринеллю 160 Мн/м2 (16 кгс/мм2).
В соответствии с внешней электронной конфигурацией атома 4d10 5s2 валентность Кадмий в соединениях равна 2 (впрочем, имеются указания на образование ионов Cd22+ при растворении Кадмий в расплавленном CdCl2). На воздухе Кадмий тускнеет, покрываясь тонкой плёнкой окиси CdO, которая защищает металл от дальнейшего окисления. При сильном нагревании на воздухе Кадмий сгорает в окись CdO — кристаллический порошок от светло-коричневого до темно-бурого цвета, плотность 8,15 г/см3; при 700 °С CdO возгоняется, не плавясь. Кадмий непосредственно соединяется с галогенами; эти соединения бесцветны; CdCl2, CdBr2 и Cdl2 очень легко растворимы в воде (около 1 ч. безводной соли в 1 ч. воды при 20 °С), CdF2 растворим труднее (1 ч. в 25 ч. воды). С серой Кадмий образует сульфид CdS от лимонно-жёлтого до оранжево-красного цвета, нерастворимый в воде и разбавленных кислотах. Кадмий легко растворяется в азотной кислоте с выделением окислов азота и образованием нитрата, который даёт гидрат Cd (NO3)2×4H2O. Из кислот — соляной и разбавленной серной Кадмий медленно выделяет водород, при выпаривании растворов из них кристаллизуются гидраты хлорида 2CdCl2×5H2O и сульфата 3CdSO4×8H2O. Растворы солей Кадмий имеют кислую реакцию вследствие гидролиза; едкие щёлочи осаждают из них белую гидроокись Cd (OH)2, нерастворимую в избытке реактива; впрочем, при действии концентриров. растворов щёлочи на Cd (OH)2 были получены гидрооксокадмиаты, например Na2[Cd (OH)]. Катион Cd2+ легко образует комплексные ионы с аммиаком [Cd (NH3)4]2+ и с цианом [Cd (CN)4]2- и [Cd (CN)6]4-. Известны многочисленные основные, двойные и комплексные соли Кадмий Соединения Кадмий ядовиты; особенно опасно вдыхание паров его окиси.
Получение и применение. Кадмий получают из побочных продуктов переработки цинковых, свинцово-цинковых и медно-цинковых руд. Эти продукты (содержащие 0,2—7% Кадмий) обрабатывают разбавленной серной кислотой, которая растворяет окиси Кадмий и цинка. Из раствора осаждают Кадмий цинковой пылью; губчатый остаток (смесь Кадмий и цинка) растворяют в разбавленной серной кислоте и выделяют Кадмий электролизом этого раствора. Электролитический Кадмий переплавляют под слоем едкого натра и отливают в палочки; чистота металла — не менее 99,98%.
Металлический Кадмий применяют в ядерных реакторах, для антикоррозионных и декоративных покрытий (см. Кадмирование), в аккумуляторах. Кадмий служит основой некоторых подшипниковых сплавов, входит в состав легкоплавких сплавов (см., например, Вуда сплав). Легкоплавкие сплавы применяют для спайки стекла с металлом, в автоматических огнетушителях, для тонких и сложных отливок в гипсовых формах и др. Сульфид Кадмий (кадмиевая жёлтая) — краска для живописи. Сульфат и амальгама Кадмий используются в нормальном элементе Вестона.
Кадмий в организме. Содержание Кадмий в растениях составляет 10-4% (на сухое вещество); у некоторых животных (губок, кишечнополостных, червей, иглокожих и оболочников) — 4×10-5—3×10-3% сухого вещества. Обнаружен у всех позвоночных животных. Наиболее богата Кадмий печень. Физиологическое значение Кадмий изучено недостаточно, но известно, что Кадмий влияет на углеводный обмен, на синтез в печени гиппуровой кислоты, на активность некоторых ферментов.
Лит.: Погодин С. А., Кадмий, в кн.: Краткая химическая энциклопедия, т. 2, М., 1963; Реми Г., Курс неорганической химии, [пер. с нем.], т. 2, М., 1966, с, 476—486.
С. А. Погодин.
|
Так же Вы можете узнать о... Миноискатель, переносной прибор для обнаружения мин, установленных в грунте или под водой. Мопертюи Пьер Луи Моро де Мопертюи (Maupertuis) Пьер Луи Моро (Moreau) де (17. «Мысль» (издательство) «Мысль», издательство социально-экономический литературы в системе Государственного комитета Совета Министров СССР по делам издательств, полиграфии и книжной торговли. Невесомость, состояние материального тела, при котором действующие на него внешние силы или совершаемое им движение не вызывают взаимных давлений частиц друг на друга. Ноб-Лейк (Knob Lake), месторождение железной руды в Канаде, в центральной части полуострова Лабрадор, на северо-западном берегу озера (провинция Квебек), в пределах Лабрадора железорудного пояса. Общая химия, курс химии, в котором излагаются основные понятия, теории и законы этой науки, строение, свойства и способы получения химических элементов и их важнейших соединений. Оптимальное программирование, то же, что математическое программирование. Очанка (Euphrasia), род растений семейства норичниковых. Пассивный участок полёта космического аппарата, участок, на котором движение космического летательного аппарата происходит при выключенных двигателях ракеты. Петрены, селище трипольской культуры у одноимённого села в Дрокиевском районе Молдавской ССР. Площица, насекомое отряда вшей. Полянка, посёлок городского типа в Барановском районе Житомирской области УССР, в 35 км от железнодорожной станции Радулино (на линии Шепетовка — Коростень). Прибалтийская операция 1944, стратегическая наступательная операция войск 1-го, 2-го и 3-го Прибалтийских, Ленинградского фронтов и сил Краснознамённого Балтийского флота в сентябре — октябре 1944 по разгрому немецко-фашистских войск на территории Советской Прибалтики во время Великой Отечественной войны 1941—45. Психическая секреция, выделение секретов пищеварительных желёз при действии раздражителей (вид, запах пищи, обстановка её приёма, разговор о еде), ранее сочетавшихся с приёмом пищи. Раймонд Тулузский, Раймунд де Сен-Жиль, Раймунд IV (Raimond de Saint-Gilles) (1041 или 1042, Тулуза, — 28. Репнин Борис Александрович Репнин, Репнин-Оболенский Борис Александрович [г. |
|