Гидратация
Большая Советская Энциклопедия. Статьи для написания рефератов, курсовых работ, научные статьи, биографии, очерки, аннотации, описания.
|
|
| ГИА |
| ГИБ |
| ГИГ |
| ГИД |
| ГИЕ |
| ГИЖ |
| ГИЗ |
| ГИЙ |
| ГИК |
| ГИЛ |
| ГИМ |
| ГИН |
| ГИО |
| ГИП |
| ГИР |
| ГИС |
| ГИТ |
| ГИФ |
| ГИЧ |
| ГИЯ |
Гидратация (от греч. hydor — вода), процессы связывания воды химическими веществами. Различают несколько видов Гидратация
Гидратация окислов приводит к гидроокисям, представляющим собой щёлочи, кислоты или амфотерные соединения. Так, присоединение воды к окиси кальция даёт гидроокись кальция (в технике этот процесс называется «гашение извести»): СаО + H2O = Ca (OH)2.
Гидратация серного ангидрида в промышленности чают серную кислоту, а окислов азота — азотную кислоту: SO2 + H2O = H2SO4, 3NO2 + H2O = 2HNO3 + NO.
При Гидратация трёхокиси мышьяка образуется слабая мышьяковистая кислота, имеющая амфотерные свойства: As2O3 + 3H2O = 2H3AsO3.
Гидратация органических соединений происходит по кратным связям; в случае циклических соединений Гидратация приводит к раскрытию циклов. Обычно эти реакции происходят в присутствии щелочей, кислот или гетерогенных катализаторов (каталитическая Гидратация). Гидратация этого типа играет огромную роль в препаративной органической химии и промышленности органического синтеза. Так, в результате прямой Гидратация олефинов получают спирты, например этиловый спирт из этилена: CH2 = CH2 + H2O ® CH3CH2OH.
Гидратация ацетилена приводит к ацетальдегиду (реакция Кучерова) (промежуточный продукт — неустойчивый виниловый спирт): CH º CH + H2O ® [СН2=СН—ОН] ® CH3CHO.
В результате Гидратация кетена образуется уксусная кислота, а окиси этилена — этиленгликоль: 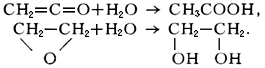
В перечисленных примерах вода реагирует таким образом, что происходит разрыв связи между атомом водорода и группой OH.
Многие неорганические и некоторые органические вещества образуют с водой твёрдые кристаллогидраты, постоянного состава, которые ведут себя как индивидуальные химические соединения. Так, безводный сульфат меди CuSO4 бесцветен; из его водных растворов кристаллизуется ярко-синий гидрат CuSO4·5H2O — медный купорос, при нагревании которого образуется сначала голубой CuSO4·3H2O, затем CuSO4·H2O белого цвета; при 258°С соль полностью обезвоживается. К этому же типу относится Гидратация молекул в растворах с образованием гидратов различного состава, находящихся в равновесии друг с другом и водой; например, при растворении спирта образуются гидраты с 3,4 и 8 молекулами H2O. При растворении электролитов происходит Гидратация ионов, затрудняющая ассоциацию последних. Энергия Гидратация в значительной степени компенсирует энергию диссоциации электролита; т. о., Гидратация ионов является одной из главных причин электролитической диссоциации в водных растворах. Образование кристаллогидратов и Гидратация молекул и ионов в растворах являются частными случаями сольватации, т. е. присоединения молекул растворителя. К Гидратация относят также процессы, приводящие к связыванию воды за счёт адсорбционных сил (см. Адсорбция). См. также Вода.
В биологических системах при Гидратация происходит присоединение (связывание) воды различными субстратами организма. Вода, входящая в образующиеся при Гидратация гидратные оболочки, составляет основное количество т. н. связанной воды протоплазмы клетки. С Гидратация связаны многие биологические процессы. Так, Гидратация ионов влияет на их проникновение в клетку, а Гидратация белков изменяет некоторые их свойства — в частности ферментативную активность.
Процесс, обратный Гидратация, т. е. потеря связанной веществами воды, называется дегидратацией. Гидратация и дегидратация постоянно происходят в процессах обмена веществ, в частности обмена воды, в организмах.
|
Так же Вы можете узнать о... Термы спектральные (англ. term, от лат. terminus — граница, предел), применяемые в спектроскопии величины, пропорциональные энергиям стационарных состояний атомов и молекул. Элементоорганические полимеры, высокомолекулярные элементоорганические соединения. Варнавино, посёлок городского типа, центр Варнавинского района Горьковской области РСФСР, на р. Жилярди Дементий Иванович Жилярди, Джилярди (Gilardi) Дементий (Доменико) Иванович (1788, Монтаньола, близ Лугано, Швейцария, — 28. Лагодехский заповедник, расположен в Грузинской ССР, в отрогах южного склона Главного Кавказского хребта, вблизи г. Омаха (Omaha), город в США, на правом берегу р. Святополк Окаянный (около 980—1019), князь туровский (988—1015) и великий князь киевский (1015—19), сын Владимира Святославича. Флеминг Александер Флеминг (Fleming) Александер (6.8.1881, Локфилд, – 11. Антиной (лат. Antinous) (год рождения неизвестен — умер 130), греческий юноша, любимец римского императора Адриана, погибший загадочной смертью в водах Нила. Гергей Шандор Гергей (Gergely) Шандор (2.2.1896, Шопронкерестур, — 14. Кантус фирмус (лат. cantus firmus, буквально — прочная, неизменная мелодия), заимствованная из какого-либо светского или культового произведения, а также специально созданная мелодия, использовавшаяся в качестве основы многоголосного музыкального сочинения. Мегарельеф (от мега... и рельеф), совокупность наиболее крупных неровностей земной поверхности. |
|