Платиновые металлы
Большая Советская Энциклопедия. Статьи для написания рефератов, курсовых работ, научные статьи, биографии, очерки, аннотации, описания.
|
|
| ПЛА |
| ПЛЕ |
| ПЛЁ |
| ПЛИ |
| ПЛО |
| ПЛУ |
| ПЛЫ |
| ПЛЬ |
| ПЛЮ |
| ПЛЯ |
Платиновые металлы, платиноиды, химические элементы второй и третьей триад VIII группы периодической системы Менделеева. К ним принадлежат: рутений (Ruthenium) Ru, родий (Rhodium) Rh, палладий (Palladium) Pd (лёгкие Платиновые металлы, плотность ~12 г/см3); осмий (Osmium) Os, иридий (Iridium) lr, платина (Platinum) Pt (тяжёлые Платиновые металлы, плотность ~22 г/см3). Серебристо-белые тугоплавкие металлы; благодаря красивому внешнему виду и высокой химической стойкости Платиновые металлы наряду с Ag и Au называют благородными металлами.
Историческая справка. Имеются указания, что самородная платина в древности была известна в Египте, Эфиопии, Греции и Южной Америке. В 16 в. исп. конкистадоры обнаружили в Южной Америке вместе с самородным золотом очень тяжёлый белый тусклый металл, который не удавалось расплавить. Испанцы назвали его платиной — уменьшительным от исп. plata — серебро. В 1744 исп. морские офицер Антонио де Ульоа привёз образцы Pt в Лондон. Они вызвали живой интерес учёных Европы. Самостоятельным металлом Pt, которую первоначально считали белым золотом, была признана в середине 18 в.
В 1803 английский учёный У. Х. Волластон обнаружил в самородной платине палладий, получивший это название от малой планеты Паллады (открытой в 1802), и родий, названный так по розовато-красному цвету его солей (от греч. rhódon — роза). В 1804 английский химик Смитсон Теннант в остатке после растворения самородной Pt в царской водке открыл ещё 2 металла. Один из них получил название иридий вследствие разнообразия окраски его солей (от греч. íris, род. падеж íridos — радуга), другой был назван осмием по резкому запаху его четырёхокиси (от греч. osmá — запах). В 1844 К. К. Клаус при исследовании остатков от аффинажа (очистки) уральской самородной Pt в Петербургском монетном дворе открыл ещё один Платиновые металлы — рутений (от позднелат. Ruthenia — Россия).
С. А. Погодин.
Распространение в природе. Платиновые металлы принадлежат к наиболее редким элементам, их среднее содержание в земной коре (кларки) точно не установлено, ориентировочные значения приведены в таблице. Самые редкие в земной коре — Rh и lr (1×10-7% по массе), наиболее распространён Os (5×10-6%). Содержание Платиновые металлы повышено в ультраосновных и основных изверженных породах, происхождение которых связано с глубинными магматическими процессами. К этим породам приурочены месторождения Платиновые металлы Ещё выше среднее содержание Платиновые металлы в каменных метеоритах, которые считаются аналогами средней мантии Земли (кларки Платиновые металлы в каменных метеоритах составляют n×10-4 — n×10-5% по массе). Для земной коры характерно самородное состояние Платиновые металлы, а у Rh, Pd, Os и Pt известны также немногочисленные соединения с серой, мышьяком и сурьмой. Установлено около 30 минералов Платиновые металлы, больше всего их у Pd (13) и Pt (9). Все минералы образовались на больших глубинах при высоких температурах и давлениях (см. Платиновые руды, Платина самородная). Платина и другие Платиновые металлы встречаются в виде примеси во многих сульфидах и силикатах ультраосновных и основных пород. Геохимия Платиновые металлы в биосфере почти не изучена, их содержание в гидросфере и живом веществе не установлено. Некоторые осадочные марганцевые руды обогащены Pt (до 1×10-3%), в углях наблюдалась концентрация Pt и Pd (1×10-6%); повышенное содержание Платиновые металлы отмечалось в фосфоритах (вятских), в золе деревьев, растущих на месторождениях Pt.
А. И. Перельман.
Физические и химические свойства. Физические и механические свойства Платиновые металлы сопоставлены в таблице. В дополнение необходимо указать, что Ru и Os очень тверды и хрупки (возможно вследствие присутствия примесей). Rh и lr обладают меньшими твёрдостью и хрупкостью, а Pd и Pt ковки, поддаются прокатке, волочению, штамповке при комнатной температуре. Интересна способность некоторых Платиновые металлы (Ru, Pd, Pt) поглощать водород. Особенно это свойственно Pd, объём которого поглощает до 900 объёмов H2. При этом Pd сохраняет металлический вид, но растрескивается и становится хрупким. Все Платиновые металлы парамагнитны. Магнитная восприимчивость cs×10-6 электро-магнитных единиц при 18 °С равна 0,05 у Os; 0,50 у Ru; 5,4 у Pd; у Rh, lr и Pt она несколько более 1,0.
Согласно давно установившейся традиции, Платиновые металлы принято помещать в VIII группу периодической системы элементов. В соответствии с этим следовало ожидать, что все Платиновые металлы должны иметь высшую степень окисления +8. Однако это наблюдается только у Ru и Os, прочие же Платиновые металлы проявляют валентность не выше +6. Объясняется это тем, что у атомов Ru и Os остаются незаполненными соответственно внутренние подуровни 4f и 5f. Поэтому для атомов Ru и Os возможно возбуждение не только с подуровней 5s и 6s на подуровни 5p и 6p, но и с подуровней 4d и 5d на подуровни 4f и 5f. Вследствие этого в атомах Ru и Os появляется по 8 непарных электронов и валентность +8. Электронные конфигурации атомов Rh, lr, Pd, Pt такой возможности не допускают. Поэтому в некоторых вариантах таблицы Менделеева эти элементы (а также Со и Ni) выносят за пределы VIII группы. Все Платиновые металлы легко образуют комплексные соединения, в которых имеют различные степени окисления и различные координационные числа. Комплексные соединения Платиновые металлы, как правило, окрашены и очень прочны.
Химические свойства Платиновые металлы имеют много общего. Все они в компактном виде (кроме Os) малоактивны. Однако в виде т. н. черни (мелкодисперсного порошка) Платиновые металлы легко адсорбируют S, галогены и др. неметаллы. (Чернь обычно получают восстановлением Платиновые металлы из водных растворов их соединений.) Компактные Ru, Rh, Os, lr, будучи сплавлены с Pt, Zn, Pb, Bi, переходят в раствор при действии царской водки, хотя она не действует на эти Платиновые металлы, взятые отдельно.
Семейство Платиновые металлы можно разделить на 3 диады (двойки), образованные двумя стоящими один под другим лёгким и тяжёлым Платиновые металлы, а именно: Ru, Os; Rh, lr; Pd, Pt.
При нагревании с O2 и сильными окислителями Ru и Os образуют легкоплавкие кристаллы — четырёхокиси (тетроксиды) — оранжевую RuO4 и желтоватую OsO4. Оба соединения летучи, пары их имеют неприятный запах и весьма ядовиты. При действии восстановителей превращаются в низшие окислы RuO2 и OsO2 или в металлы. Со щелочами RuO4 образует рутенаты, например рутенат калия K2RuO по реакции:
RuO4 + 2KOH = K2RuO4 + 1/2O2 + H2O.
При действии хлора K2RuO4 превращается в перрутенат калия:
K2RuO4 + 1/2Cl2 = KRuO4 + KCI.
Четырёхокись OsO4 даёт с KOH комплексное соединение K2[OsO4(OH)2]. С фтором и др. галогенами Ru и Os легко реагируют при нагревании, образуя соединения типа RuF3, RuF4, RuF5, RuF6. Осмий даёт подобные же соединения, кроме OsF3; существование OsF8 не подтверждено. Весьма интересны комплексные соединения Ru с ксеноном Xe [RuF6] (канадский химик Н. Бартлетт, 1962), а также с молекулярным азотом — [(NO)(NH3)4 N2Ru (NH3)4 NO] CI (советский химик Н. М. Синицын, 1962) и [Ru (NH3)5N2] Cl2 (канадский химик А. Аллен, 1965).
На компактные Rh и lr царская водка не действует. При прокаливании в O2образуются окислы Rh2O3 и Ir2O3, разлагающиеся при высоких температурах.
Pd легко растворяется при нагревании в HNO3 и концентрированной H2SO4 с образованием нитрата Pd (NO3)2 и сульфата PdSO4. На Pt эти кислоты не действуют. Царская водка растворяет Pd и Pt, причём образуются комплексные кислоты — тетрахлоропалладиевая кислота H2[PdCl4] и гексахлороплатиновая — коричнево-красные кристаллы состава H2[PtCl6]×6H2O Из её солей наибольшее значение для технологии Платиновые металлы имеет хлороплатинат аммония (NH4)2[PtCl6] — светло-жёлтые кристаллы, малорастворимые в воде и почти не растворимые в концентрированных растворах NH4CI. При прокаливании они разлагаются по реакции:
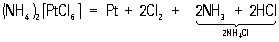
При этом Pt получается в мелкораздробленном виде (т. н. платиновая губка, или губчатая платина).
Получение. Разделение Платиновые металлы и получение их в чистом виде очень сложно вследствие большого сходства их химических свойств; это требует большой затраты труда, времени, дорогих реактивов. Для получения чистой Pt исходные материалы — самородную платину, платиновые шлихи (тяжёлые остатки от промывки платиноносных песков), лом (негодные для употребления изделия из Pt и её сплавов) обрабатывают царской водкой при подогревании. В раствор переходят: Pt, Pd, частично Rh, lr в виде комплексных соединений H2[PtCl6], H2[PdCl4], Нз [RhCl6] и H2[IrCl6], а также Fe и Cu в виде FeClз и CuCl2. Нерастворимый в царской водке остаток состоит из осмистого иридия, хромистого железняка (FeCrO2), кварца и др. минералов.
Из раствора осаждают Pt в виде (NH4)2[PtCl6] хлористым аммонием. Но чтобы в осадок вместе с Pt не выпал lr в виде аналогичного нерастворимого соединения (NH4)2[lrCl6] (остальные Платиновые металлы NH4Cl не осаждает), предварительно восстанавливают Ir (+4) до Ir (+3) (например, прибавлением сахара C12H22O11 по способу И. И. Черняева). Соединение (NH4)3[IrCl6] растворимо и не загрязняет осадка.
Хлороплатинат аммония отфильтровывают, промывают концентрированным раствором NH4CI (в котором осадок практически не растворим), высушивают и прокаливают. Полученную губчатую платину спрессовывают, а затем оплавляют в кислородно-водородном пламени или в электрической печи высокой частоты. Из фильтрата, оставшегося после осаждения (NH4)2[PtCl6], и из осмистого иридия извлекают прочие Платиновые металлы путём сложных химических операций. В частности, для перевода в растворимое состояние нерастворимых в царской водке Платиновые металлы и осмистого иридия используют спекание с перекисями BaO2 или Na2O2. Применяют также хлорирование — нагревание смеси Pt-концентратов с NaCl и NaOH в струе хлора.
В результате аффинажа получают труднорастворимые комплексные соединения: гексахлорорутенат аммония (NH4)3[RuCl6], дихлорид тетрамминдиоксоосмия [OsO2(NH3)4] Cl2, хлорпентамминдихлорид родия [Rh (NH3)5CI] Cl2, гексахлороиридат аммония (NH4)2[lrCl6] и дихлордиаммин палладия [Pd (NH3)2] Cl2. Прокаливанием перечисленных соединений в атмосфере H2 получают Платиновые металлы в виде губки, например
[OsO2(NH3)4] Cl2 + 3H2 = Os + 2H2O + 4NH3 + 2HCI
[Pd (NH3)2] Cl2 + H2 = Pd + 2NH3 + 2HCI.
Губчатые Платиновые металлы сплавляют в вакуумной электрической печи высокой частоты.
Применяют и др. способы аффинажа, в частности основанные на использовании ионитов.
Основным источником получения Платиновые металлы служат сульфидные медно-никелевые руды, месторождения которых находятся в СССР (Норильск, Красноярский край), Канаде (округ Садбери, провинция Онтарио), ЮАР и др. странах. В результате сложной металлургической переработки этих руд благородные металлы переходят в т. н. черновые металлы — нечистые никель и медь. Платиновые металлы собираются почти полностью в черновом Ni, a Ag и Au — в черновой Cu. При последующем электролитическом рафинировании Ag, Au и Платиновые металлы осаждаются на дне электролитической ванны в виде шлама, который отправляют на аффинаж.
Свойства платиновых металлов
|
Свойство |
Ru |
Rh |
Pd |
Os |
lr |
Pt |
|
Атомный номер |
44 |
45 |
46 |
76 |
77 |
78 |
|
Атомная масса |
101,07 |
102,9055 |
11906,4 |
190,2 |
192,22 |
195,09 |
|
Среднее содержание в земной коре, % по массе |
(5·10-7) |
1·10-7 |
1·10-6 |
5·10-6 |
1·10-7 |
5·10-7 |
|
Массовые числа природных изотопов (в скобках указано распространение |
96, 98, 99, 100, 101,102 (31, 61), 104 |
103 (100) |
102, 104, 105 (22,23), 106 (27,33), 108 (26,71), 110 (11,8) |
184, 186, 187, 188, 189, 190 (26,4), 192 (41,0) |
191 (38,5) 193 (61,5) |
190, 192 (оба слабо радиоактивны), 194 (32,9), 196(25,2), 198 (7,19) |
|
Кристаллическая решётка, параметры в |
Гексагональная плотнейшей упаковки* |
Гранецентрированная кубическая |
Гранецентрированная кубическая |
Гексагональная плотнейшей упаковки |
Гранецентрированная кубическая |
Гранецентрированная кубическая |
|
Атомный радиус, |
1,34 |
1,34 |
1,37 |
1,36 |
1,36 |
1,39 |
|
Ионный радиус, |
Ru4+ 0,67 |
Rh4+ 0,68 |
Pd4+ 0,65 |
Os4+ 0,65 |
lr4+ 0,68 |
Pt4+ 0,65 |
|
Конфигурация внешних электронных оболочек |
4d75s1 |
4d85s1 |
4d10 |
5d66s2 |
5d76s2 |
5d96s1 |
|
Состояния окисления (наиболее характерные набраны полужирным шрифтом) |
1,2,3,4,5,6,7,8 |
1,3,4 |
2,3,4 |
2,3,4,6,8 |
1,2,3,4,6 |
2,3,4 |
|
Плотность (при 20 °С), г/см3 |
12,2 |
12,42 |
11,97 |
22,5 |
22,4 |
21,45 |
|
Температура плавления, °С |
2250 |
1960 |
1552 |
ок. 3050 |
2410 |
1769 |
|
Температура кипения, °С |
ок. 4900 |
ок. 4500 |
ок. 3980 |
ок. 5500 |
ок. 5300 |
ок. 4530 |
|
Линейный коэффициент теплового расширения |
9,1×10-6 (20°С) |
8,5×10-6 (0—100 °С) |
11,67×10-6 (0°С) |
4,6×10-6° |
6,5×10-6 (0—100°С) |
8,9×10-6 (0°С) |
|
Теплоёмкость, кал/(г ×°С) |
0,057 (0°C) |
0,059 (20 °C) |
0,058 (0°С) |
0,0309 (°С) |
0,0312 |
0,0314 (0°С) |
|
кдж/(кг ×К.) |
0,0312 |
0,247 |
0,243 |
0,129 |
0,131 |
0,131 |
|
Теплопроводность кал/(см ×сек °С) |
— |
0,36 |
0,17 |
— |
— |
0,17 |
|
вт/(м ×К) |
— |
151 |
71 |
— |
— |
71 |
|
Удельное электросопротивление, ом×см×10-6 (или ом×см×10-8) |
7,16-7,6 (0°C) |
4,7 (0°C) |
10,0 (0°C) |
9,5 (0°C) |
5,40 (25°C) |
9,81 (0°C) |
|
Температурный коэффициент электросопротивления |
44,9×10-4 (0—100°C) |
45,7×10-4 (0—100°C) |
37,7×10-4 (0—100°C) |
42×10-4 (0—100°C) |
39,25×10-4 (0—100°C) |
39,23×10-4 (0—100°C) |
|
Модуль нормальной упругости, кгс/мм2** |
47200 |
32000 |
12600 |
58000 |
52000 |
17330 |
|
Твёрдость по Бринеллю, кгсlмм2 |
220 |
139 |
49 |
400 |
164 |
47 |
|
Предел прочности при растяжении, кгс/мм2 |
— |
48 |
18,5 |
— |
23 |
14,3 |
|
Относительное удлинение при разрыве, % |
— |
15 |
24—30 |
— |
2 |
31 |
* Для Ru обнаружены полиморфные превращения при температурах 1035, 1190 и 1500°С.
** Все механические свойства даны для отожжённых Платиновые металлы при комнатной температуре; 1 кгс/мм2= 10 Мн/м2. Некоторые параметры не приводятся как установленные неточно.
Применение. Из всех Платиновые металлы наибольшее применение имеет Pt. До 2-й мировой войны 1939—45 свыше 50% Pt служило для изготовления ювелирных изделий. В последние 2—3 десятилетия около 90% Pt потребляется для научных и промышленных целей. Из Pt делают лабораторные приборы — тигли, чашки, термометры сопротивления и др., — применяемые в аналитических и физико-химических исследованиях. Около 50% потребляемой Pt (частично в виде сплавов с Rh, Pd, lr, см. Платиновые сплавы) применяют как катализаторы в производстве азотной кислоты окислением NH3, в нефтехимической промышленности и мн. др. Pt и её сплавы используются для изготовления аппаратуры для некоторых химических производств. Около 25% Pt расходуется в электротехнике, радиотехнике, автоматике, телемеханике, медицине. Применяется Pt и как антикоррозионное покрытие (см. Платинирование).
lr применяют главным образом в виде сплава Pt + 10% lr. Из такого сплава сделаны международные эталоны метра и килограмма. Из него изготовляют тигли, в которых выращивают кристаллы для лазеров, контакты для особо ответственных узлов в технике слабых токов. Из сплава lr с Os делают опоры для стрелок компасов и др. приборов.
Способностью сорбировать H2 и катализировать многие химические реакции обладает Ru; он входит в состав некоторых сплавов, обладающих высокой твёрдостью и стойкостью против истирания и окисления.
Rh благодаря своей способности отражать около 80% лучей видимой части спектра, а также высокой стойкости против окисления является хорошим материалом для покрытия рефлекторов прожекторов и зеркал точных приборов. Но главная область его применения — сплавы с Pt, из которых изготовляют лабораторную и заводскую аппаратуру, проволоку для термоэлектрических пирометров и др.
Pd в виде черни применяется преимущественно как катализатор во многих химических производствах, в частности в процессах гидрогенизации. Из Pd изготовляют ювелирные изделия. Раствор H2[PdCl4] — чувствительный реактив на окись углерода. Полоска бумаги, пропитанная им, чернеет уже при содержании 0,02 мг/л СО в воздухе вследствие выделения Pd в виде черни по реакции:
H2[PdCI4] +H2O + CO = 4HCI + CO2 + Pd.
Аффинаж Платиновые металлы сопровождается выделением ядовитых Cl2 и NOCI, что требует хорошей вентиляции и возможной герметизации аппаратуры. Пары легколетучих RuO4 и OsO4 вызывают общее отравление, а также тяжёлые поражения дыхательных путей и глаз (вплоть до потери зрения). При попадании этих соединений на кожу она чернеет (вследствие восстановления их до RuO2, OsO2, Ru или Os) и воспаляется, причём могут образоваться трудно заживающие язвы. Меры предосторожности: хорошая вентиляция, резиновые перчатки, защитные очки, поглощение паров RuO4 и OsO4 растворами щелочей.
Лит.: Некрасов Б. В., Основы общей химии, т. 3, М., 1970, с. 170—204; Рипан P., Четяну И., Неорганическая химия, т. 2, Химия металлов, пер. с рум., М., 1972, с. 615—675; Плаксин И. Н., Иридий, в кн.: Краткая хим. энциклопедия, т. 2, М., 1963; Леонова Т. Н., Осмий, Палладий, там же, т. 3, М., 1964; её же, Платина, Родий, Рутений, там же, т. 4, М., 1965; Химия рутения, М., 1965; Федоров И. А., Родий, М., 1966; Звягинцев О. Е., Аффинаж золота, серебра и металлов платиновой группы, 3 изд., М., 1945; Черняев И. И., Комплексные соединения переходных металлов, М., 1973; Аналитическая химия платиновых металлов, М., 1972; «Известия Сектора платины и других благородных металлов», в. 1—32, Л. — М., 1920—1955 (в. 1—3 вышли под заглавием «Известия Института по изучению платины и других благородных металлов»); Platinum group metals and compounds. Wash., 1971.
С. А. Погодин.
В организме Платиновые металлы представлены главным образом элементом рутением, а также искусственными радиоизотопами рутения и родия. Морские и пресноводные водоросли концентрируют радиоизотопы рутения в сотни и тысячи раз (по сравнению со средой), ракообразные — в десятки и сотни, моллюски — до десятков, рыбы и головастики лягушек — от единиц до сотен. 106Ru интенсивно мигрирует в почве, накопляясь в корнях наземных растений. У наземных млекопитающих радиоизотопы Ru всасываются через пищеварительный тракт, проникают в лёгкие, отлагаются в почках, печени, мышцах, скелете. Радиоизотопы Ru — составная часть радиоактивного загрязнения биосферы.
Лит.: Булдаков Л. А., Москалев Ю. И., Проблемы распределения и экспериментальной оценки допустимых уровней Cs137, Sr90 и Ru106, М., 1968.
Г. Г. Поликарпов.
|
Так же Вы можете узнать о... Трёхфазная цепь, трёхфазная система, совокупность трёх однофазных электрических цепей переменного тока (называемых фазами), в которых действуют три переменных напряжения одинаковой частоты, сдвинутых по фазе друг относительно друга; частный случай многофазной системы. Участия система, в капиталистических странах система владения акционерными компаниями ценными бумагами др. Фрунзе (пос. гор. типа в Киргизской ССР) Фрунзе (до 1937 — Кадамджай), посёлок городского типа во Фрунзенском районе Ошской обл. Центральное статистическое управление при Совете Министров СССР (ЦСУ СССР), союзно-республиканский орган централизованного руководства делом социалистического учёта и статистики в СССР. Шварц Антон Исаакович [24.1(5.2). 1896, Москва, — 21. Элементарные функции, класс функций, состоящий из многочленов, рациональных функций, показательных функций, логарифмических функций, тригонометрических функций и обратных тригонометрических функций, а также функций, получающихся из перечисленных выше с помощью четырёх арифметических действий и суперпозиций (образование сложной функции), примененных конечное число раз; например, Амфибии (греч. amphibia), класс позвоночных животных; то же, что земноводные. Африфа Аквази Аманква (р. 24.4.1936, Мампонг), государственный деятель Республики Гана, бригадный генерал (с 1967). Берданка, однозарядная винтовка, состоявшая на вооружении русской армии в 70—90-х гг. Броктон (Brockton), город на северо-востоке США, в штате Массачусетс, в 30 км от Бостона. |
|
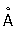 (при 20
(при 20 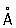
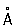 (по Л. Полингу)
(по Л. Полингу)