Медь
Большая Советская Энциклопедия. Статьи для написания рефератов, курсовых работ, научные статьи, биографии, очерки, аннотации, описания.
|
|
| МЕА |
| МЕБ |
| МЕВ |
| МЕГ |
| МЕД |
| МЕЕ |
| МЕЖ |
| МЕЗ |
| МЕИ |
| МЕЙ |
| МЕК |
| МЕЛ |
| МЕМ |
| МЕН |
| МЕО |
| МЕП |
| МЕР |
| МЕС |
| МЕТ |
| МЕФ |
| МЕХ |
| МЕЦ |
| МЕЧ |
| МЕШ |
| МЕЩ |
Медь (лат. Cuprum), Cu, химический элемент I группы периодической системы Менделеева; атомный номер 29, атомная масса 63,546; мягкий, ковкий металл красного цвета. Природная Медь состоит из смеси двух стабильных изотопов — 63Cu (69,1 % ) и 65Cu (30,9 % ).
Историческая справка. Медь относится к числу металлов, известных с глубокой древности. Раннему знакомству человека с Медь способствовало то, что она встречается в природе в свободном состоянии в виде самородков (см. Медь самородная), которые иногда достигают значительных размеров. Медь и её сплавы сыграли большую роль в развитии материальной культуры (см. Бронзовый век). Благодаря лёгкой восстановимости окислов и карбонатов Медь была, по-видимому, первым металлом, который человек научился восстановлять из кислородных соединений, содержащихся в рудах. Латинское название Медь происходит от названия острова Кипр, где древние греки добывали медную руду. В древности для обработки скальной породы её нагревали на костре и быстро охлаждали, причём порода растрескивалась. Уже в этих условиях были возможны процессы восстановления. В дальнейшем восстановление вели в кострах с большим количеством угля и с вдуванием воздуха посредством труб и мехов. Костры окружали стенками, которые постепенно повышались, что привело к созданию шахтной печи. Позднее методы восстановления уступили место окислительной плавке сульфидных медных руд с получением промежуточных продуктов — штейна (сплава сульфидов), в котором концентрируется Медь, и шлака (сплава окислов).
Распространение в природе. Среднее содержание Медь в земной коре (кларк) 4,7·10-3 % (по массе), в нижней части земной коры, сложенной основными породами, её больше (1·10-2 %), чем в верхней (2·10-3 %), где преобладают граниты и другие кислые изверженные породы. Медь энергично мигрирует как в горячих водах глубин, так и в холодных растворах биосферы; сероводород осаждает из природных вод различные сульфиды Медь, имеющие большое промышленное значение. Среди многочисленных минералов Медь преобладают сульфиды, фосфаты, сульфаты, хлориды, известны также самородная Медь, карбонаты и окислы.
Медь — важный элемент жизни, она участвует во многих физиологических процессах. Среднее содержание Медь в живом веществе 2·10-4 %, известны организмы — концентраторы Медь В таёжных и других ландшафтах влажного климата Медь сравнительно легко выщелачивается из кислых почв, здесь местами наблюдается дефицит Медь и связанные с ним болезни растений и животных (особенно на песках и торфяниках). В степях и пустынях (с характерными для них слабощелочными растворами) Медь малоподвижна; на участках месторождений Медь наблюдается её избыток в почвах и растениях, отчего болеют домашние животные.
В речной воде очень мало Медь, 1·10-7 %. Приносимая в океан со стоком Медь сравнительно быстро переходит в морские илы. Поэтому глины и сланцы несколько обогащены Медь (5,7·10-3 % ), а морская вода резко недосыщена Медь (3·10-7 %).
В морях прошлых геологических эпох местами происходило значительное накопление Медь в илах, приведшее к образованию месторождений (например, Мансфельд в ГДР). Медь энергично мигрирует и в подземных водах биосферы, с этими процессами связано накопление руд Медь в песчаниках.
Физические и химические свойства. Цвет Медь красный, в изломе розовый, при просвечивании в тонких слоях зеленовато-голубой. Металл имеет гранецентрированную кубическую решётку с параметром а = 3,6074 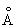 ; плотность 8,96 г/см3 (20 °С). Атомный радиус 1,28
; плотность 8,96 г/см3 (20 °С). Атомный радиус 1,28 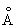 ; ионные радиусы Cu+ 0,98
; ионные радиусы Cu+ 0,98 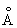 ; Cu2+ 0,80
; Cu2+ 0,80 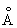 ; tпл. 1083 °С; tкип. 2600 °С; удельная теплоёмкость (при 20 °С) 385,48 дж/(кг·К), то есть 0,092 кал/(г·°С). Наиболее важные и широко используемые свойства Медь: высокая теплопроводность — при 20 °С 394,279 вт/(м·К), то есть 0,941 кал/(см·сек·°С); малое электрическое сопротивление — при 20 °С 1,68·10-8ом·м. Термический коэффициент линейного расширения 17,0·10-6. Давление паров над Медь ничтожно, давление 133,322 н/м2 (то есть 1 мм рт. ст.) достигается лишь при 1628 °С. Медь диамагнитна; атомная магнитная восприимчивость 5,27·10-6. Твёрдость Медь по Бринеллю 350 Мн/м2 (то есть 35 кгс/мм2); предел прочности при растяжении 220 Мн/м2(то есть 22 кгс/мм2); относительное удлинение 60 %, модуль упругости 132·103Мн/м2 (то есть 13,2·103кгс/мм2). Путём наклёпа предел прочности может быть повышен до 400—450 Мн/м2, при этом удлинение уменьшается до 2 %, а электропроводность уменьшается на 1—3 %. Отжиг наклёпанной Медь следует проводить при 600—700 °С. Небольшие примеси Bi (тысячные доли % ) и Pb (сотые доли % ) делают Медь красноломкой, а примесь S вызывает хрупкость на холоде.
; tпл. 1083 °С; tкип. 2600 °С; удельная теплоёмкость (при 20 °С) 385,48 дж/(кг·К), то есть 0,092 кал/(г·°С). Наиболее важные и широко используемые свойства Медь: высокая теплопроводность — при 20 °С 394,279 вт/(м·К), то есть 0,941 кал/(см·сек·°С); малое электрическое сопротивление — при 20 °С 1,68·10-8ом·м. Термический коэффициент линейного расширения 17,0·10-6. Давление паров над Медь ничтожно, давление 133,322 н/м2 (то есть 1 мм рт. ст.) достигается лишь при 1628 °С. Медь диамагнитна; атомная магнитная восприимчивость 5,27·10-6. Твёрдость Медь по Бринеллю 350 Мн/м2 (то есть 35 кгс/мм2); предел прочности при растяжении 220 Мн/м2(то есть 22 кгс/мм2); относительное удлинение 60 %, модуль упругости 132·103Мн/м2 (то есть 13,2·103кгс/мм2). Путём наклёпа предел прочности может быть повышен до 400—450 Мн/м2, при этом удлинение уменьшается до 2 %, а электропроводность уменьшается на 1—3 %. Отжиг наклёпанной Медь следует проводить при 600—700 °С. Небольшие примеси Bi (тысячные доли % ) и Pb (сотые доли % ) делают Медь красноломкой, а примесь S вызывает хрупкость на холоде.
Л. Бухаидзе (Грузинская ССР). Панно «Весна». 1967. Музей искусства народов Востока. Москва.
По химическим свойствам Медь занимает промежуточное положение между элементами первой триады VIII группы и щелочными элементами I группы системы Менделеева. Медь, как и Fe, Со, Ni, склонна к комплексообразованию, даёт окрашенные соединения, нерастворимые сульфиды и т. д. Сходство с щелочными металлами незначительно. Так, Медь образует ряд одновалентных соединений, однако для неё более характерно 2-валентное состояние. Соли одновалентной Медь в воде практически нерастворимы и легко окисляются до соединений 2-валентной Медь; соли 2-валентной Медь, напротив, хорошо растворимы в воде и в разбавленных растворах полностью диссоциированы. Гидратированные ионы Cu2+ окрашены в голубой цвет. Известны также соединения, в которых Медь 3-валентна. Так, действием перекиси натрия на раствор куприта натрия Na2CuO2 получен окисел Cu2O3 — красный порошок, начинающий отдавать кислород уже при 100 °С. Cu2O3 — сильный окислитель (например, выделяет хлор из соляной кислоты).
Химическая активность Медь невелика. Компактный металл при температурах ниже 185 °С с сухим воздухом и кислородом не взаимодействует. В присутствии влаги и CO2 на поверхности Медь образуется зелёная плёнка основного карбоната. При нагревании Медь на воздухе идёт поверхностное окисление; ниже 375 °С образуется CuO, а в интервале 375—1100 °С при неполном окислении Медь — двухслойная окалина, в поверхностном слое которой находится CuO, а во внутреннем — Cu2O (см. Меди окислы). Влажный хлор взаимодействует с Медь уже при обычной температуре, образуя хлорид CuCl2, хорошо растворимый в воде. Медь легко соединяется и с другими галогенами (см. Меди галогениды). Особое сродство проявляет Медь к сере и селену; так, она горит в парах серы (см. Меди сульфиды). С водородом, азотом и углеродом Медь не реагирует даже при высоких температурах. Растворимость водорода в твёрдой Медь незначительна и при 400 °С составляет 0,06 мг в 100 г Медь Водород и другие горючие газы (CO, CH4), действуя при высокой температуре на слитки Медь, содержащие Cu2O, восстановляют её до металла с образованием CO2 и водяного пара. Эти продукты, будучи нерастворимыми в Медь, выделяются из неё, вызывая появление трещин, что резко ухудшает механические свойства Медь
При пропускании NH3 над раскалённой Медь образуется Cu3N. Уже при температуре каления Медь подвергается воздействию окислов азота, а именно NO, N2O (с образованием Cu2O) и NO2 (с образованием CuO). Карбиды Cu2C2 и CuC2 могут быть получены действием ацетилена на аммиачные растворы солей Медь Нормальный электродный потенциал Медь для реакции Cu2+ + 2e ® Сu равен +0,337 в, а для реакции Cu+ + е ® Сu равен +0,52 в. Поэтому Медь вытесняется из своих солей более электроотрицательными элементами (в промышленности используется железо) и не растворяется в кислотах-неокислителях. В азотной кислоте Медь растворяется с образованием Cu(NO3)2 и окислов азота, в горячей концентрации H2SO4 — с образованием CuSO4 и SO2, в нагретой разбавленной H2SO4 — при продувании через раствор воздуха. Все соли Медь ядовиты (см. Меди карбонаты, Меди нитрат, Меди сульфат).
Медь в двухи одновалентном состоянии образует многочисленные весьма устойчивые комплексные соединения. Примеры комплексных соединений одновалентной Медь: (NH4)2CuBr3; K3Cu(CN)4 — комплексы типа двойных солей; [Сu {SC (NH2)}2]CI и другие. Примеры комплексных соединений 2-валентной Медь: CsCuCI3, K2CuCl4 — тип двойных солей. Важное промышленное значение имеют аммиачные комплексные соединения Медь: [Сu (NH3)4] SO4, [Сu (NH3)2] SO4.
Получение. Медные руды характеризуются невысоким содержанием Медь Поэтому перед плавкой тонкоизмельчённую руду подвергают механическому обогащению; при этом ценные минералы отделяются от основной массы пустой породы; в результате получают ряд товарных концентратов (например, медный, цинковый, пиритный) и отвальные хвосты.
Маска, изображающая бога Шипе. Культура Западной Мексики. Национальный музей антропологии. Мехико.
В мировой практике 80 % Медь извлекают из концентратов пирометаллургическими методами, основанными на расплавлении всей массы материала. В процессе плавки, вследствие большего сродства Медь к сере, а компонентов пустой породы и железа к кислороду, Медь концентрируется в сульфидном расплаве (штейне), а окислы образуют шлак. Штейн отделяют от шлака отстаиванием.
На большинстве современных заводов плавку ведут в отражательных или в электрических печах. В отражательных печах рабочее пространство вытянуто в горизонтальном направлении; площадь пода 300 м2 и более (30 м´ 10 м), необходимое для плавления тепло получают сжиганием углеродистого топлива (естественный газ, мазут, пылеуголь) в газовом пространстве над поверхностью ванны. В электрических печах тепло получают пропусканием через расплавленный шлак электрического тока (ток подводится к шлаку через погруженные в него графитовые электроды).
Однако и отражательная, и электрическая плавки, основанные на внешних источниках теплоты, — процессы несовершенные. Сульфиды, составляющие основную массу медных концентратов, обладают высокой теплотворной способностью. Поэтому всё больше внедряются методы плавки, в которых используется теплота сжигания сульфидов (окислитель — подогретый воздух, воздух, обогащенный кислородом, или технический кислород). Мелкие, предварительно высушенные сульфидные концентраты вдувают струей кислорода или воздуха в раскалённую до высокой температуры печь. Частицы горят во взвешенном состоянии (кислородно-взвешенная плавка). Можно окислять сульфиды и в жидком состоянии; эти процессы усиленно исследуются в СССР и за рубежом (Япония, Австралия, Канада) и становятся главным направлением в развитии пирометаллургии сульфидных медных руд.
Богатые кусковые сульфидные руды (2—3 % Cu) с высоким содержанием серы (35—42 % S) в ряде случаев непосредственно направляются на плавку в шахтных печах (печи с вертикально расположенным рабочим пространством). В одной из разновидностей шахтной плавки (медно-серная плавка) в шихту добавляют мелкий кокс, восстановляющий в верхних горизонтах печи SO2 до элементарной серы. Медь в этом процессе также концентрируется в штейне.
Получающийся при плавке жидкий штейн (в основном Cu2S, FeS) заливают в конвертер — цилиндрический резервуар из листовой стали, выложенный изнутри магнезитовым кирпичом, снабженный боковым рядом фурм для вдувания воздуха и устройством для поворачивания вокруг оси. Через слой штейна продувают сжатый воздух. Конвертирование штейнов протекает в две стадии. Сначала окисляется сульфид железа, и для связывания окислов железа в конвертер добавляют кварц; образуется конвертерный шлак. Затем окисляется сульфид меди с образованием металлической Медь и SO2. Эту черновую Медь разливают в формы. Слитки (а иногда непосредственно расплавленную черновую Медь) с целью извлечения ценных спутников (Au, Ag, Se, Fe, Bi и других) и удаления вредных примесей направляют на огневое рафинирование. Оно основано на большем, чем у меди, сродстве металлов-примесей к кислороду: Fe, Zn, Co и частично Ni и другие в виде окислов переходят в шлак, а сера (в виде SO2) удаляется с газами. После удаления шлака Медь для восстановления растворённой в ней Cu2O «дразнят», погружая в жидкий металл концы сырых берёзовых или сосновых брёвен, после чего отливают его в плоские формы. Для электролитического рафинирования эти слитки подвешивают в ванне с раствором CuSO4, подкислённым H2SO4. Они служат анодами. При пропускании тока аноды растворяются, а чистая Медь отлагается на катодах — тонких медных листах, также получаемых электролизом в специальных матричных ваннах. Для выделения плотных гладких осадков в электролит вводят поверхностно-активные добавки (столярный клей, тиомочевину и другие). Полученную катодную Медь промывают водой и переплавляют. Благородные металлы, Se, Te и другие ценные спутники Медь концентрируются в анодном шламе, из которого их извлекают специальной переработкой. Никель концентрируется в электролите; выводя часть растворов на упаривание и кристаллизацию, можно получить Ni в виде никелевого купороса.
Наряду с пирометаллургическими применяют также гидрометаллургические методы получения Медь (преимущественно из бедных окисленных и самородных руд). Эти методы основаны на избирательном растворении медьсодержащих минералов, обычно в слабых растворах H2SO4 или аммиака. Из раствора Медь либо осаждают железом, либо выделяют электролизом с нерастворимыми анодами. Весьма перспективны применительно к смешанным рудам комбинированные гидрофлотационные методы, при которых кислородные соединения Медь растворяются в сернокислых растворах, а сульфиды выделяются флотацией. Получают распространение и автоклавные гидрометаллургические процессы, идущие при повышенных температурах и давлении.
Применение. Большая роль Медь в технике обусловлена рядом её ценных свойств и прежде всего высокой электропроводностью, пластичностью, теплопроводностью. Благодаря этим свойствам Медь — основной материал для проводов; свыше 50 % добываемой Медь применяют в электротехнической промышленности. Все примеси понижают электропроводность Медь, а потому в электротехнике используют металл высших сортов, содержащий не менее 99,9 % Cu. Высокие теплопроводность и сопротивление коррозии позволяют изготовлять из Медь ответственные детали теплообменников, холодильников, вакуумных аппаратов и т. п. Около 30—40 % Медь используют в виде различных сплавов, среди которых наибольшее значение имеют латуни (от 0 до 50 % Zn) и различные виды бронз; оловянистые, алюминиевые, свинцовистые, бериллиевые и т. д. (подробнее см. Медные сплавы). Кроме нужд тяжёлой промышленности, связи, транспорта, некоторое количество Медь (главным образом в виде солей) потребляется для приготовления минеральных пигментов, борьбы с вредителями и болезнями растений, в качестве микроудобрений, катализаторов окислительных процессов, а также в кожевенной и меховой промышленности и при производстве искусственного шёлка.
Л. В. Ванюков.
Э. Будвитене (Литовская ССР). «Рыбаки» (Центральная часть триптиха «Наше море»). 1971. Каунасский художественный музей им. Медь К. Чурлёниса.
Стакан. Россия. Середина 18 в. Исторический музей. Москва.
Медь как художественный материал используется с медного века (украшения, скульптура, утварь, посуда). Кованые и литые изделия из Медь и сплавов (см. Бронза) украшаются чеканкой, гравировкой и тиснением. Лёгкость обработки Медь (обусловленная её мягкостью) позволяет мастерам добиваться разнообразия фактур, тщательности проработки деталей, тонкой моделировки формы. Изделия из Медь отличаются красотой золотистых или красноватых тонов, а также свойством обретать блеск при шлифовке. Медь нередко золотят, патинируют (см. Патина), тонируют, украшают эмалью. С 15 века Медь применяется также для изготовления печатных форм (см. Гравюра).
Медь в организме. Медь — необходимый для растений и животных микроэлемент. Основная биохимическая функция Медь — участие в ферментативных реакциях в качестве активатора или в составе медьсодержащих ферментов. Количество Медь в растениях колеблется от 0,0001 до 0,05 % (на сухое вещество) и зависит от вида растения и содержания Медь в почве. В растениях Медь входит в состав ферментов-оксидаз и белка пластоцианина. В оптимальных концентрациях Медь повышает холодостойкость растений, способствует их росту и развитию. Среди животных наиболее богаты Медь некоторые беспозвоночные (у моллюсков и ракообразных в гемоцианине содержится 0,15—0,26 % Медь). Поступая с пищей, Медь всасывается в кишечнике, связывается с белком сыворотки крови — альбумином, затем поглощается печенью, откуда в составе белка церулоплазмина возвращается в кровь и доставляется к органам и тканям.
Содержание Медь у человека колеблется (на 100 г сухой массы) от 5 мг в печени до 0,7 мг в костях, в жидкостях тела — от 100 мкг (на 100 мл) в крови до 10 мкг в спинномозговой жидкости; всего Медь в организме взрослого человека около 100 мг. Медь входит в состав ряда ферментов (например, тирозиназы, цитохромоксидазы), стимулирует кроветворную функцию костного мозга. Малые дозы Медь влияют на обмен углеводов (снижение содержания сахара в крови), минеральных веществ (уменьшение в крови количества фосфора) и др. Увеличение содержания Медь в крови приводит к превращению минеральных соединений железа в органические, стимулирует использование накопленного в печени железа при синтезе гемоглобина.
При недостатке Медь злаковые растения поражаются так называемой болезнью обработки, плодовые — экзантемой; у животных уменьшаются всасывание и использование железа, что приводит к анемии, сопровождающейся поносом и истощением. Применяются медные микроудобрения и подкормка животных солями Медь (см. Микроудобрения). Отравление Медь приводит к анемии, заболеванию печени, болезни Вильсона. У человека отравление возникает редко благодаря тонким механизмам всасывания и выведения Медь Однако в больших дозах Медь вызывает рвоту; при всасывании Медь может наступить общее отравление (понос, ослабление дыхания и сердечной деятельности, удушье, коматозное состояние).
Антропоморфная фигура. Дерево, медь. Габон (народ бакота). Музей Гиме. Париж.
И. Ф. Грибовская.
В медицине сульфат М. применяют как антисептическое и вяжущее средство в виде глазных капель при конъюнктивитах и глазных карандашей для лечения трахомы. Раствор сульфата Медь используют также при ожогах кожи фосфором. Иногда сульфат Медь применяют как рвотное средство. Нитрат Медь употребляют в виде глазной мази при трахоме и конъюнктивитах.
Лит.: Смирнов В. И., Металлургия меди и никеля, Свердловск — Медь, 1950; Аветисян Х. К., Металлургия черновой меди, Медь, 1954; Газарян Л. Медь, Пирометаллургия меди, Медь, 1960; Справочник металлурга по цветным металлам, под редакцией Н. Н. Мурача, 2 изд., т. 1, Медь, 1953, т. 2, Медь, 1947; Левинсон Н. P., [Изделия из цветного и чёрного металла], в книге: Русское декоративное искусство, т. 1—3, Медь, 1962—65; Hadaway W. S., Illustrations of metal work in brass and copper mostly South Indian, Madras, 1913; Wainwright G. A., The occurrence of tin and copper near bybios, «Journal of Egyptian archaeology», 1934, v. 20, pt 1, p. 29—32; BergsÆe P., The gilding process and the metallurgy of copper and lead among the precolumbian Indians, Kbh., 1938; Фриден Э., Роль соединений меди в природе, в книге: Горизонты биохимии, перевод с английского, Медь, 1964; его же. Биохимия меди, в книге: Молекулы и клетки, перевод с английского, в. 4, Медь, 1969; Биологическая роль меди, Медь, 1970.
|
Так же Вы можете узнать о... Каховский плацдарм, укрепленный район на левом берегу Днепра около Б. Лаурана Лучано Лаурана (Laurana; собств. Луциян из Враны, Lucijan Vranjanin) Лучано (около 1420—25, Задар или Врана, Хорватия, — 1479, Пезаро, Марке), итальянский архитектор. Монгольские языки, языки монгольских народов (см. Пантограф (подвижн. состава) Пантограф подвижного состава, то же, что токосъёмник. Расин (город в США) Расин (Racine), город на С. США, в штате Висконсин. Соломаткин Леонид Иванович [1837, Суджа, ныне Курской области, — похоронен 6(18). Тянь-Шань Восточный, название восточной части Тянь-Шаня на территории Китая. Чечевички (бот.), линзообразные рыхлые скопления клеток в перидерме, выступающие на поверхности стволов многолетних ветвей, а иногда и корней древесных растений в виде бугорков. Алкино, климато-кумысолечебный курорт в 35 км от Уфы, в 1,5 км от станции Куйбышевской ж. Боткуль, Боткалы-Сор, горько-солёное бессточное озеро на С. Гериндо (Gerindo, сокращенное от Gerakan rajat Indonesia — Индонезийское народное движение), индонезийская политическая организация, созданная группой левых националистов и коммунистов в 1937 в ходе национально-освободительной борьбы индонезийского народа. Енакиевский металлургический завод, предприятие чёрной металлургии СССР. Квара (Kwara), штат в западной Нигерии. Площадь 4,3 тыс. Левоэсеровский мятеж 1918, контрреволюционное выступление левых эсеров 6—7 июля в Москве, предпринятое по решению ЦК левых эсеров с целью сорвать Брестский мирный договор, спровоцировать войну с Германией и свергнуть Советское правительство. Монфокон Бернар де Монфокон (Montfaucon) Бернар де (13.1.1655, Сулаж, — 21. Парамагнитный усилитель, квантовый усилитель СВЧ, рабочим веществом которого является кристалл с примесью парамагнитных ионов. Рахья Иван Абрамович Рахья Иван (Юкка) Абрамович (19.7.1887, Кронштадт, — 31. Сопряжённые дифференциальные уравнения, понятие теории дифференциальных уравнений. Угольная рыба (Anoplopoma firnbria), морская рыба отряда скорпенообразных. |
|




