Титан (хим. элемент)
Большая Советская Энциклопедия. Статьи для написания рефератов, курсовых работ, научные статьи, биографии, очерки, аннотации, описания.
|
|
| ТИА |
| ТИБ |
| ТИВ |
| ТИГ |
| ТИД |
| ТИЕ |
| ТИЗ |
| ТИЙ |
| ТИК |
| ТИЛ |
| ТИМ |
| ТИН |
| ТИО |
| ТИП |
| ТИР |
| ТИС |
| ТИТ |
| ТИУ |
| ТИФ |
| ТИХ |
| ТИЦ |
| ТИЧ |
| ТИШ |
| ТИЩ |
Титан (лат. Titanium), Ti, химический элемент IV группы периодической системы Менделеева; атомный номер 22, атомная масса 47,90; имеет серебристо-белый цвет, относится к лёгким металлам. Природный Титан (хим. элемент) состоит из смеси пяти стабильных изотопов: 46Ti (7,95%), 47Ti (7,75%), 48Ti (73,45%), 49Ti (5,51%), 50Ti (5,34%). Известны искусственные радиоактивные изотопы 45Ti (Ti1/2 = 3,09ч, 51Ti (Ti1/2 = 5,79 мин) и др.
Историческая справка. Титан (хим. элемент) в виде двуокиси был открыт английским любителем-минералогом У. Грегором в 1791 в магнитных железистых песках местечка Менакан (Англия); в 1795 немецкий химик М. Г. Клапрот установил, что минерал рутил представляет собой природный окисел этого же металла, названного им «титаном» [в греческой мифологии титаны — дети Урана (Неба) и Геи (Земли)]. Выделить Титан (хим. элемент) в чистом виде долго не удавалось; лишь в 1910 американский учёный М. А. Хантер получил металлический Титан (хим. элемент) нагреванием его хлорида с натрием в герметичной стальной бомбе; полученный им металл был пластичен только при повышенных температурах и хрупок при комнатной из-за высокого содержания примесей. Возможность изучать свойства чистого Титан (хим. элемент) появилась только в 1925, когда нидерландские учёные А. Ван-Аркел и И. де Бур методом термической диссоциации иодида титана получили металл высокой чистоты, пластичный при низких температурах.
Распространение в природе. Титан (хим. элемент) — один из распространённых элементов, среднее содержание его в земной коре (кларк) составляет 0,57% по массе (среди конструкционных металлов по распространённости занимает 4-е место, уступая железу, алюминию и магнию). Больше всего Титан (хим. элемент) в основных породах так называемой «базальтовой оболочки» (0,9%), меньше в породах «гранитной оболочки» (0,23%) и ещё меньше в ультраосновных породах (0,03%) и др. К горным породам, обогащенным Титан (хим. элемент), относятся пегматиты основных пород, щелочные породы, сиениты и связанные с ними пегматиты и др. Известно 67 минералов Титан (хим. элемент), в основном магматического происхождения; важнейшие — рутил и ильменит (см. также Титановые руды).
В биосфере Титан (хим. элемент) в основном рассеян. В морской воде его содержится 1·10-7%; Титан (хим. элемент) — слабый мигрант.
Физические свойства. Титан (хим. элемент) существует в виде двух аллотропических модификаций: ниже температуры 882,5 °С устойчива a-форма с гексагональной плотноупакованной решёткой (а = 2,951 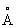 , с = 4,679
, с = 4,679 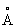 ), а выше этой температуры — b-форма с кубической объёмно-центрированной решёткой а = 3,269
), а выше этой температуры — b-форма с кубической объёмно-центрированной решёткой а = 3,269 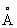 . Примеси и легирующие добавки могут существенно изменять температуру a/b превращения.
. Примеси и легирующие добавки могут существенно изменять температуру a/b превращения.
Плотность a-формы при 20 °С 4,505 г/см3 а при 870 °С 4,35 г/см3 b-формы при 900 °С 4,32 г/см3; атомный радиус Ti 1,46 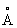 , ионные радиусы Ti+ 0,94
, ионные радиусы Ti+ 0,94 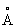 , Ti2+ 0,78
, Ti2+ 0,78 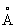 , Ti3+ 0,69
, Ti3+ 0,69 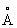 , Ti4+ 0,64
, Ti4+ 0,64 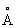 , tпл1668±5°С, tкип 3227 °С; теплопроводность в интервале 20—25 °С 22,065 вт/(м × К) [0,0527 кал/(см ×сек × °С)]; температурный коэффициент линейного расширения при 20 °С 8,5×10-6, в интервале 20—700 °С 9,7×10-6; теплоёмкость 0,523 кдж/(кг × К) [0,1248 кал/(г ×°С)]; удельное электросопротивление 42,1×10-6ом ×см при 20 °С; температурный коэффициент электросопротивления 0,0035 при 20 °С; обладает сверхпроводимостью ниже 0,38±0,01 К. Титан (хим. элемент) парамагнитен, удельная магнитная восприимчивость (3,2±0,4)×10-6 при 20°С. Предел прочности 256 Мн/м2 (25,6 кгс/мм2), относительное удлинение 72%, твёрдость по Бринеллю менее 1000 Мн/м2 (100 кгс/мм2). Модуль нормальной упругости 108000 Мн/м2 (10800 кгс/мм2). Металл высокой степени чистоты ковок при обычной температуре.
, tпл1668±5°С, tкип 3227 °С; теплопроводность в интервале 20—25 °С 22,065 вт/(м × К) [0,0527 кал/(см ×сек × °С)]; температурный коэффициент линейного расширения при 20 °С 8,5×10-6, в интервале 20—700 °С 9,7×10-6; теплоёмкость 0,523 кдж/(кг × К) [0,1248 кал/(г ×°С)]; удельное электросопротивление 42,1×10-6ом ×см при 20 °С; температурный коэффициент электросопротивления 0,0035 при 20 °С; обладает сверхпроводимостью ниже 0,38±0,01 К. Титан (хим. элемент) парамагнитен, удельная магнитная восприимчивость (3,2±0,4)×10-6 при 20°С. Предел прочности 256 Мн/м2 (25,6 кгс/мм2), относительное удлинение 72%, твёрдость по Бринеллю менее 1000 Мн/м2 (100 кгс/мм2). Модуль нормальной упругости 108000 Мн/м2 (10800 кгс/мм2). Металл высокой степени чистоты ковок при обычной температуре.
Применяемый в промышленности технический Титан (хим. элемент) содержит примеси кислорода, азота, железа, кремния и углерода, повышающие его прочность, снижающие пластичность и влияющие на температуру полиморфного превращения, которое происходит в интервале 865—920 °С. Для технического Титан (хим. элемент) марок ВТ1-00 и ВТ1-0 плотность около 4,32 г/см3, предел прочности 300— 550 Мн/м2 (30—55 кгс/мм2), относительное удлинение не ниже 25%, твёрдость по Бринеллю 1150—1650 Мн/м2 (115—165 кгс/мм2). Конфигурация внешней электронной оболочки атома Ti 3d24s2.
Химические свойства. Чистый Титан (хим. элемент) — химически активный переходный элемент, в соединениях имеет степени окисления + 4, реже +3 и +2. При обычной температуре и вплоть до 500—550 °С коррозионно устойчив, что объясняется наличием на его поверхности тонкой, но прочной окисной плёнки.
С кислородом воздуха заметно взаимодействует при температуре выше 600 °С с образованием TiO2 (см. также Титана окислы). Тонкая титановая стружка при недостаточной смазке может загораться в процессе механической обработки. При достаточной концентрации кислорода в окружающей среде и повреждении окисной плёнки путём удара или трения возможно загорание металла при комнатной температуре и в сравнительно крупных кусках.
Окисная плёнка не защищает Титан (хим. элемент) в жидком состоянии от дальнейшего взаимодействия с кислородом (в отличие, например, от алюминия), и поэтому его плавка и сварка должны проводиться в вакууме, в атмосфере нейтрального газа или под флюсом. Титан (хим. элемент) обладает способностью поглощать атмосферные газы и водород, образуя хрупкие сплавы, непригодные для практического использования; при наличии активированной поверхности поглощение водорода происходит уже при комнатной температуре с небольшой скоростью, которая значительно возрастает при 400 °С и выше. Растворимость водорода в Титан (хим. элемент) является обратимой, и этот газ можно удалить почти полностью отжигом в вакууме. С азотом Титан (хим. элемент) реагирует при температуре выше 700 °С, причём получаются нитриды типа TiN; в виде тонкого порошка или проволоки Титан (хим. элемент) может гореть в атмосфере азота. Скорость диффузии азота и кислорода в Титан (хим. элемент) значительно ниже, чем водорода. Получаемый в результате взаимодействия с этими газами слой отличается повышенными твёрдостью и хрупкостью и должен удаляться с поверхности титановых изделий путём травления или механической обработки. Титан (хим. элемент) энергично взаимодействует с сухими галогенами (см. Титана галогениды), по отношению к влажным галогенам устойчив, так как влага играет роль ингибитора.
Металл устойчив в азотной кислоте всех концентраций (за исключением красной дымящейся, вызывающей коррозионное растрескивание Титан (хим. элемент), причём реакция иногда идёт со взрывом), в слабых растворах серной кислоты (до 5% по массе). Соляная, плавиковая, концентрированная серная, а также горячие органические кислоты: щавелевая, муравьиная и трихлоруксусная реагируют с Титан (хим. элемент)
Титан (хим. элемент) коррозионно устойчив в атмосферном воздухе, морской воде и морской атмосфере, во влажном хлоре, хлорной воде, горячих и холодных растворах хлоридов, в различных технологических растворах и реагентах, применяемых в химической, нефтяной, бумагоделательной и др. отраслях промышленности, а также в гидрометаллургии. Титан (хим. элемент) образует с С, В, Se, Si металлоподобные соединения, отличающиеся тугоплавкостью и высокой твёрдостью. Карбид TiG (tпл 3140 °С) получают нагреванием смеси TiO2 с сажей при 1900—2000 °С в атмосфере водорода; нитрид TiN (tпл 2950 °С) — нагреванием порошка Титан (хим. элемент) в азоте при температуре выше 700 °С. Известны силициды TiSi2, Ti5Si3, TiSi и бориды TiB, Ti2B5, TiB2. При температурах 400—600 °С Титан (хим. элемент) поглощает водород с образованием твёрдых растворов и гидридов (TiH, TiH2). При сплавлении TiO2 со щелочами образуются соли титановых кислот метаи ортотитанаты (например, Na2TiO3 и Na4TiO4), а также полититанаты (например, Na2Ti2O5 и Na2Ti3O7). К титанатам относятся важнейшие минералы Титан (хим. элемент), например ильменит FeTiO3, перовскит CaTiO3. Все титанаты малорастворимы в воде. Двуокись Титан (хим. элемент), титановые кислоты (осадки), а также титанаты растворяются в серной кислоте с образованием растворов, содержащих титанилсульфат TiOSO4. При разбавлении и нагревании растворов в результате гидролиза осаждается H2TiO3, из которой получают двуокись Титан (хим. элемент) При добавлении перекиси водорода в кислые растворы, содержащие соединения Ti (IV), образуются перекисные (надтитановые) кислоты состава H4TiO5 и H4TiO8 и соответствующие им соли; эти соединения окрашены в жёлтый или оранжево-красный цвет (в зависимости от концентрации Титан (хим. элемент)), что используется для аналитического определения Титан (хим. элемент)
Получение. Наиболее распространённым методом получения металлического Титан (хим. элемент) является магниетермический метод, то есть восстановление тетрахлорида Титан (хим. элемент) металлическим магнием (реже — натрием):
TiCl4 + 2Mg= Ti + 2MgCl2.
В обоих случаях исходным сырьём служат окисные руды Титан (хим. элемент) — рутил, ильменит и др. В случае руд типа ильменитов Титан (хим. элемент) в форме шлака отделяется от железа путём плавки в электропечах. Шлак (так же, как рутил) подвергают хлорированию в присутствии углерода с образованием тетрахлорида Титан (хим. элемент), который после очистки поступает в восстановительный реактор с нейтральной атмосферой.
Титан (хим. элемент) по этому процессу получается в губчатом виде и после измельчения переплавляется в вакуумных дуговых печах на слитки с введением легирующих добавок, если требуется получить сплав. Магниетермический метод позволяет создать крупное промышленное производство Титан (хим. элемент) с замкнутым технологическим циклом, так как образующийся при восстановлении побочный продукт — хлорид магния направляется на электролиз для получения магния и хлора.
В ряде случаев для производства изделий из Титан (хим. элемент) и его сплавов выгодно применять методы порошковой металлургии. Для получения особо тонких порошков (например, для радиоэлектроники) можно использовать восстановление двуокиси Титан (хим. элемент) гидридом кальция.
Мировое производство металлического Титан (хим. элемент) развивалось весьма быстро: около 2 т в 1948, 2100 т в 1953, 20 000 т в 1957; в 1975 оно превысило 50 000 т.
Применение. Основные преимущества Титан (хим. элемент) перед др. конструкционными металлами: сочетание лёгкости, прочности и коррозионной стойкости. Титановые сплавы по абсолютной, а тем более по удельной прочности (то есть прочности, отнесённой к плотности) превосходят большинство сплавов на основе др. металлов (например, железа или никеля) при температурах от -250 до 550 °С, а по коррозионности они сравнимы со сплавами благородных металлов (см. также Лёгкие сплавы). Однако как самостоятельный конструкционный материал Титан (хим. элемент) стал применяться только в 50-е гг. 20 в. в связи с большими техническими трудностями его извлечения из руд и переработки (именно поэтому Титан (хим. элемент) условно относили к редким металлам). Основная часть Титан (хим. элемент) расходуется на нужды авиационной и ракетной техники и морского судостроения (см. также Титановые сплавы). Сплавы Титан (хим. элемент) с железом, известные под названием «ферротитан» (20—50% Титан (хим. элемент)), в металлургии качественных сталей и специальных сплавов служат легирующей добавкой и раскислителем.
Технический Титан (хим. элемент) идёт на изготовление ёмкостей, химических реакторов, трубопроводов, арматуры, насосов и др. изделий, работающих в агрессивных средах, например в химическом машиностроении. В гидрометаллургии цветных металлов применяется аппаратура из Титан (хим. элемент) Он служит для покрытия изделий из стали (см. Титанирование). Использование Титан (хим. элемент) даёт во многих случаях большой технико-экономический эффект не только благодаря повышению срока службы оборудования, но и возможности интенсификации процессов (как, например, в гидрометаллургии никеля). Биологическая безвредность Титан (хим. элемент) делает его превосходным материалом для изготовления оборудования для пищевой промышленности и в восстановительной хирургии. В условиях глубокого холода прочность Титан (хим. элемент) повышается при сохранении хорошей пластичности, что позволяет применять его как конструкционный материал для криогенной техники. Титан (хим. элемент) хорошо поддаётся полировке, цветному анодированию и др. методам отделки поверхности и поэтому идёт на изготовление различных художественных изделий, в том числе и монументальной скульптуры. Примером может служить памятник в Москве, сооруженный в честь запуска первого искусственного спутника Земли. Из соединений титана практического значение имеют окислы Титан (хим. элемент), галогениды Титан (хим. элемент), а также силициды Титан (хим. элемент), используемые в технике высоких температур; бориды Титан (хим. элемент) и их сплавы, применяемые в качестве замедлителей в ядерных энергетических установках благодаря их тугоплавкости и большому сечению захвата нейтронов. Карбид Титан (хим. элемент), обладающий высокой твёрдостью, входит в состав инструментальных твёрдых сплавов, используемых для изготовления режущих инструментов и в качестве абразивного материала.
Двуокись титана и титанат бария служат основой титановой керамики, а титанат бария — важнейший сегнетоэлектрик.
С. Г. Глазунов.
Титан в организме. Титан (хим. элемент) постоянно присутствует в тканях растений и животных. В наземных растениях его концентрация — около 10-4%, в морских — от 1,2 ×10-3 до 8 ×10-2%, в тканях наземных животных — менее 2 ×10-4%, морских — от 2 ×10-4 до 2 ×10-2%. Накапливается у позвоночных животных преимущественно в роговых образованиях, селезёнке, надпочечниках, щитовидной железе, плаценте; плохо всасывается из желудочно-кишечного тракта. У человека суточное поступление Титан (хим. элемент) с продуктами питания и водой составляет 0,85 мг; выводится с мочой и калом (0,33 и 0,52 мг соответственно). Относительно малотоксичен.
Лит.: Глазунов С. Г., Моисеев В. Н., Конструкционные титановые сплавы, М., 1974; Металлургия титана, М., 1968; Горощенко Я. Г., Химия титана, [ч. 1—2], К., 1970—72; Zwicker U., Titan und Titanlegierungen, B., 1974; Bowen H. I. M., Trace elements in biochemistry, L.— N. Y., 1966.
|
Так же Вы можете узнать о... Сабза, сушёный виноград бессемянных сортов с белыми ягодами (кишмиш белый овальный и др. Фотографические эффекты, общее название явлений, нарушающих однозначную связь между экспозициейН, которую испытал фотографический материал, и оптической плотностью D почернения фотографического, полученного после проявления этого материала. Баланс общественного продукта, см. в ст. Баланс народного хозяйства СССР. Дентин (от лат. dens, родительный падеж dentis — зуб), разновидность костной ткани, составляющая главную массу зуба и обнаруживаемая также в плакоидной чешуе. Криптодепрессия (от крипто... и депрессия), затопленное понижение земной поверхности, дно которого хотя бы частично опускается ниже уровня моря, а водная поверхность лежит выше этого уровня (например, озеро Байкал, Ладожское озеро). Орбиты искусственных космических объектов, траектории движения космических аппаратов (КА). Слепуны, семейство змей; то же, что слепозмейки. Четвёртая венерическая болезнь, то же, что лимфогранулематоз паховый. Буланов Анатолий Петрович [5(17).8.1858, Петербург, — 1. Зеин (от лат. zea — кукуруза), белок растительного происхождения из группы проламинов; содержится в зёрнах кукурузы (Zea mays). Магдагачи, посёлок городского типа, центр Тыгдинского района Амурской области РСФСР. Половые поры, непарные или парные отверстия у круглоротых и некоторых костистых рыб, соединяющие полость тела с наружной средой и служащие для выведения половых продуктов. Теплоизоляционные работы, работы по устройству теплоизоляции конструкций зданий и сооружений, трубопроводов, промышленного оборудования, средств транспорта и др. «Academia» «Acadmia», советское издательство. Основано в 1922 в Петрограде как частное, затем преобразовано в издательство при Государственном институте истории искусств в Ленинграде. Гао (Gao), город на В. Мали, на левом берегу р. Каххар Абдулла [4(17).9.1907, Кокакд, — 24.5. Музей Революции СССР (с 1968 — Центральный ордена Ленина музей Революции СССР), создан по решению ЦИК СССР от 9 мая 1924, открыт в октябре того же года. Ронгалит , техническое название натриевой соли ронгалитовой (формальдегидсульфоксиловой) кислоты, неизвестной в свободном состоянии, HOCH2S (O) ONa×2H2О. |
|