Кобальт
Большая Советская Энциклопедия. Статьи для написания рефератов, курсовых работ, научные статьи, биографии, очерки, аннотации, описания.
|
|
| КОА |
| КОБ |
| КОВ |
| КОГ |
| КОД |
| КОЖ |
| КОЗ |
| КОИ |
| КОЙ |
| КОК |
| КОЛ |
| КОМ |
| КОН |
| КОО |
| КОП |
| КОР |
| КОС |
| КОТ |
| КОУ |
| КОФ |
| КОХ |
| КОЦ |
| КОЧ |
| КОШ |
| КОЩ |
| КОЭ |
| КОЮ |
| КОЯ |
Кобальт (лат. Cobaltum), Со, химический элемент первой триады VIII группы периодической системы Менделеева; атомный номер 27, атомная масса 58,9332; тяжёлый металл серебристого цвета с розоватым отливом. В природе элемент представлен одним устойчивым изотопом 59Со; из полученных искусственно радиоактивных изотопов важнейший 60Со.
Историческая справка. Окись Кобальт применялась в Древнем Египте, Вавилоне, Китае для окрашивания стекол и эмалей в синий цвет. Для той же цели в 16 в. в Западной Европе стали пользоваться цафрой, или сафлором, — серой землистой массой, которая получалась при обжиге некоторых руд, носивших название «кобольд». Эти руды выделяли при обжиге обильный ядовитый дым, а из продукта их обжига выплавить металл не удавалось. Средневековые рудокопы и металлурги считали это проделками мифических существ — кобольдов (от нем. Kobold — домовой, гном). В 1735 шведский химик Г. Брандт, нагревая в горне с дутьём смесь цафры с углем и флюсом, получил металл, который назвал «корольком кобольда». Вскоре это название было изменено на «кобольт», а затем на «кобальт».
Распространение в природе. Содержание Кобальт в литосфере 1,8·10-3% по массе. В земной коре он мигрирует в магмах, горячих и холодных водах. При магматической дифференциации Кобальт накапливается главным образом в верхней мантии: его среднее содержание в ультраосновных породах 2·10-2%. С магматическими процессами связано образование так называемых ликвационных месторождений кобальтовых руд. Концентрируясь из горячих подземных вод, Кобальт образует гидротермальные месторождения; в них Со связан с Ni, As, S, Cu. Известно около 30 минералов Кобальт (см. Кобальтовые руды).
В биосфере Кобальт преимущественно рассеивается, однако на участках, где есть растения — концентраторы Кобальт, образуются кобальтовые месторождения. В верхней части земной коры наблюдается резкая дифференциация Кобальт — в глинах и сланцах в среднем содержится 2·10-3% Кобальт, в песчаниках 3·10-5, в известняках 1·10-5. Наиболее бедны Кобальт песчаные почвы лесных районов. В поверхностных водах Кобальт мало, в Мировом океане его лишь 5·10-8%. Будучи слабым водным мигрантом, Кобальт легко переходит в осадки, адсорбируясь гидроокисями марганца, глинами и др. высокодисперсными минералами.
Физические и химические свойства. При обычной температуре и до 417°С кристаллическая решётка Кобальт гексагональная плотноупакованная (с периодами а = 2,5017 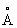 , с = 4,614
, с = 4,614 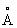 ), выше этой температуры решётка Кобальт кубическая гранецентрированная (а = 3,5370
), выше этой температуры решётка Кобальт кубическая гранецентрированная (а = 3,5370 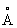 ). Атомный радиус 1,25
). Атомный радиус 1,25 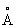 , ионные радиусы Co2+0,78
, ионные радиусы Co2+0,78 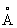 и Co3+0,64
и Co3+0,64 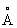 . Плотность 8,9 г/см3 (при 20°С): tnл 1493° Со, tкип 3100°С. Теплоёмкость 0,44 кдж/(кг·К), или 0,1056 кал/(г·°С); теплопроводность 69,08 вт/(м·К), или 165 кал/(см·сек·°С) при 0—100 °С. Удельное электросопротивление 5,68·10-8 ом·м, или 5,68·10-6ом·см (при 0°С). Кобальт ферромагнитен, причём сохраняет ферромагнетизм от низких температур до точки Кюри, Q= 1121 °С (см. Ферромагнетизм). Механические свойства Кобальт зависят от способа механической и термической обработки. Предел прочности при растяжении 500 Мн/м2 (или 50 кгс/мм2) для кованого и отожжённого Кобальт; 242— 260 Мн/м2 для литого; 700 Мн/м2 для проволоки. Твёрдость по Бринеллю 2,8 Гн/м2(или 280 кгс/мм2) для наклёпанного металла, 3,0 Гн/м2 для осажденного электролизом; 1,2—1,3 Гн/м2 для отожжённого.
. Плотность 8,9 г/см3 (при 20°С): tnл 1493° Со, tкип 3100°С. Теплоёмкость 0,44 кдж/(кг·К), или 0,1056 кал/(г·°С); теплопроводность 69,08 вт/(м·К), или 165 кал/(см·сек·°С) при 0—100 °С. Удельное электросопротивление 5,68·10-8 ом·м, или 5,68·10-6ом·см (при 0°С). Кобальт ферромагнитен, причём сохраняет ферромагнетизм от низких температур до точки Кюри, Q= 1121 °С (см. Ферромагнетизм). Механические свойства Кобальт зависят от способа механической и термической обработки. Предел прочности при растяжении 500 Мн/м2 (или 50 кгс/мм2) для кованого и отожжённого Кобальт; 242— 260 Мн/м2 для литого; 700 Мн/м2 для проволоки. Твёрдость по Бринеллю 2,8 Гн/м2(или 280 кгс/мм2) для наклёпанного металла, 3,0 Гн/м2 для осажденного электролизом; 1,2—1,3 Гн/м2 для отожжённого.
Конфигурация внешних электронных оболочек атома Кобальт 3d74s2. В соединениях Кобальт проявляет переменную валентность. В простых соединениях наиболее устойчив Со (II), в комплексных — Со (III). Для Со (I) и Co (IV) получены только немногочисленные комплексные соединения. При обыкновенной температуре компактный Кобальт стоек против действия воды и воздуха. Мелко раздробленный Кобальт, полученный восстановлением его окиси водородом при 250 °С (пирофорный Кобальт), на воздухе самовоспламеняется, превращаясь в СоО. Компактный Кобальт начинает окисляться на воздухе выше 300 °С; при красном калении он разлагает водяной пар: Со + H2O = CoO + H2. С галогенами Кобальт легко соединяется при нагревании, образуя галогениды СоХ2. При нагревании Кобальт взаимодействует с S, Se, Р, As, Sb, С, Si, В, причём состав получающихся соединений иногда не удовлетворяет указанным выше валентным состояниям (например, Со2Р, Co2As, CoSb2, Со3С, CoSi3). В разбавленных соляной и серной кислотах Кобальт медленно растворяется с выделением водорода и образованием соответственно хлорида CoCl2 и сульфата CoSO4. Разбавленная азотная кислота растворяет Кобальт с выделением окислов азота и образованием нитрата Co (NO3)2. Концентрированная HNO3 пассивирует Кобальт (см. Пассивирование металлов). Названные соли Со (II) хорошо растворимы в воде [при 25 °С 100 г воды растворяют 52,4 г CoCl2, 39,3 г CoSO4, 136,4 г. Со (NO3)2]. Едкие щёлочи осаждают из растворов солей Со2+ синюю гидроокись Со (ОН)2, которая постепенно буреет вследствие окисления кислородом воздуха до Со (ОН)3. Нагревание в кислороде при 400—500 °С переводит CoO в чёрную закись-окись Co3O4, или CoO·Co2O3 — соединение типа шпинели. Соединение того же типа CoAl2O4 или CoAl2O3 синего цвета (тенарова синь, открытая в 1804 Л. Ж. Тенаром) получается при прокаливании смеси CoO и Al2O3 при температуре около 1000 °С.
Из простых соединений Со (III) известны лишь немногие. При действии фтора на порошок Со или CoCl2 при 300—400 °С образуется коричневый фторид CoF3. Комплексные соединения Со (III) весьма устойчивы и получаются легко. Например, KNO2 осаждает из растворов солей Со (II), содержащих CH3COOH, жёлтый труднорастворимый гексанитрокобальтат (III) калия K3[Co (NO2)6]. Весьма многочисленны кобальтаммины (прежнее название кобальтиаки) — комплексные соединения Со (III), содержащие аммиак или некоторые органические амины.
Получение и применение. Минералы Кобальт редки и не образуют значительных рудных скоплений. Главным источником промышленного получения Кобальт служат руды никеля, содержащие Кобальт как примесь. Переработка этих руд весьма сложна, и её способ зависит от состава руды. В конечном итоге получают раствор хлоридов Кобальт и никеля, содержащий примеси Cu2+, Pb2+, Bi3+. Действием H2S осаждают сульфиды Cu, Pb, Bi, после чего пропусканием хлора переводят Fe (II) в Fe (lll) и добавлением СаСО3 осаждают Fe (OH)3 и CaHAsO4. От никеля Кобальт отделяют по реакции: 2CoCl2+NaCIO+4NaOH+H2O = 2Co (OH)3¯+5NaCI. Почти весь никель остаётся в растворе. Чёрный осадок Со (ОН)3 прокаливают для удаления воды; полученный окисел Co3O4 восстанавливают водородом или углеродом. Металлический Кобальт, содержащий до 2—3% примесей (Ni, Fе, Cu и др.), может быть очищен электролизом.
Кобальт применяется главным образом в виде сплавов; таковы кобальтовые сплавы, а также сплавы на основе др. металлов, где Кобальт служит легирующим элементом. Сплавы Кобальт используют в качестве жаропрочных и жаростойких материалов, при изготовлении постоянных магнитов, режущего инструмента и др. Порошкообразный Кобальт, а также Co3O4 служат катализаторами. Фторид CoF3 применяется как сильный фторирующий агент, тенарова синь и особенно силикат К. и калия (см. Смальта) — как краски в керамической и стекольной промышленности. Соли Кобальт применяют в сельском хозяйстве как микроудобрения, а также для подкормки животных.
С. А. Погодин.
Из искусственно радиоактивных изотопов Кобальт наибольшее значение имеет 60Со с периодом полураспада T1/2 = 5,27 года, широко используемый как гамма-излучатель. В технике его применяют для гамма-дефектоскопии. В медицине — главным образом при лучевой терапии опухолей (см. Гамма-установка) и для стерилизации медикаментов. Он служит также для уничтожения насекомых в зерне и овощах и для консервирования пищевых продуктов. Др. радиоактивные изотопы — 56Co (T1/2 = 77 сут), 57Со (270 сут) и 58Со (72 сут) как менее опасные (небольшой период полураспада) используют в качестве изотопных индикаторов при исследовании обмена веществ, в частности для изучения распределения Кобальт в организме животных (с помощью радиоактивного Кобальт исследовали проницаемость плаценты и т.п.).
Кобальт в организме. Постоянно присутствуя в тканях животных и растений, Кобальт участвует в обменных процессах. В животном организме содержание Кобальт зависит от его уровня в кормовых растениях и почвах. Концентрация Кобальт в растениях пастбищ и лугов в среднем составляет 2,2·10-5—4,5·10-5% на сухое вещество. Способность к накоплению Кобальт у бобовых выше, чем у злаковых и овощных растений. В связи с высокой способностью к концентрации Кобальт морские водоросли по его содержанию мало отличаются от наземных растений, хотя в морской воде Кобальт значительно меньше, чем в почвах. Суточная потребность человека в Кобальт равна примерно 7—15 мкг и удовлетворяется за счёт его поступления с пищей. Потребность животных в Кобальт зависит от их вида, возраста и продуктивности. Наиболее нуждаются в Кобальт жвачные, которым он необходим для развития симбиотической микрофлоры в желудке (главным образом в рубце). Суточная потребность в Кобальт у дойных коров составляет 7—20 мг, у овец — около 1 мг. При недостатке Кобальт в рационе снижается продуктивность животных, нарушаются обмен веществ и кроветворение, у жвачных возникают эндемичные заболевания — акобальтозы. Биологическая активность Кобальт определяется его участием в построении молекулы витамина B12 и его коферментных форм, фермента транскарбоксилазы. Кобальт необходим для проявления активности ряда ферментов. Он влияет на обмен белка и синтез нуклеиновых кислот, на обмен углеводов и жиров, окислительно-восстановительные реакции в животном организме. Кобальт — мощный активатор кроветворения и синтеза эритропоэтинов. Кобальт участвует в ферментных системах клубеньковых бактерий, осуществляющих фиксацию атмосферного азота; стимулирует рост, развитие и продуктивность бобовых и растений ряда др. семейств.
Ю. И. Раецкая.
Лит.: Перельман Ф. М., Кобальт, в кн.: Краткая химическая энциклопедия, т. 2, М., 1963; Некрасов Б. В., Основы общей химии, т. 3, М., 1970; Гудима Н. В., Металлургия кобальта, в кн.: Справочник металлурга по цветным металлам, т. 2, М., 1947; Ястребов А. П., Действие кобальта на образование эритроцитов, в кн.: Патофизиология эритропоэза (Тр. 7 конференции Уральского Межобластного общества патофизиологов), Свердловск, 1965; Ягодин Б. А., Кобальт в жизни растений, М., 1970; Trace element metabolism in animals. Proceedings of International symposium Aberdeen, Scotland, July 1969, Edin. — L., 1970; Northrop D. B., Transcarboxylase, «Journal of Biological Chemistry», 1969, v. 244, № 21, p. 5808—27.
|
Так же Вы можете узнать о... Силоэ Диего де Силоэ (Siloé) Диего де (около 1495, Бургос, — 22. Сонгкхла, Сонкла, город в Таиланде, на восточном побережье полуострова Малакка. «Строгий стиль», период в развитии древнегреческого искусства, охватывающий 1-ю половину 5 в. Театры Советской Армии и Военно-морского флота . Трансгрессия (географич.) Трансгрессия (от лат. transgressio — переход, передвижение), процесс наступания моря на сушу, происходящий в большинстве случаев в результате опускания суши (реже вследствие поднятия уровня океана). Униваленты (от уни... и лат. valens, родительный падеж valentis – сильный), единичные, неспаренные хромосомы в первом делении мейоза. «Фиюзат», азербайджанский литературно-художественный и общественно-политический иллюстрированный еженедельник. Хесс Вальтер Рудольф Хесс (Hess) Вальтер Рудольф (17.3.1881, Фрауэнфельд, — 12. Цыдендамбаев Чимит-Доржи (р. 23.2.1918, деревня Тарбагатай, ныне Заиграевского района Бурятской АССР), бурятский советский писатель, родился в крестьянской семье. Шереметев Борис Петрович [25.4(5.5).1652, Москва, — 17(28). Электромеханический преобразователь, устройство для преобразования механических перемещений (колебаний) в изменение электрического тока или напряжения (электрический сигнал) и наоборот. Янус (спутник планеты Сатурн) Янус,спутник планеты Сатурн, диаметр около 220 км, среднее расстояние от центра планеты 160 тыс. Александр Невский (около 1220 — 14.11.1263), русский государственный деятель, полководец, князь новгородский [1236—51], великий князь владимирский с 1252. Аракчеев Алексей Андреевич [23.9.(4.10).1769, Новгородской губернии, — 21. Бакунин Михаил Александрович [18(30).5.1814, Новоторжский уезд Тверской губернии, — 19. Бестужевские курсы, женское высшее учебное заведение, основанное в Петербурге в 1878; получили название по фамилии профессора русской истории К. Бристоль, Бристол (Bristol), город (графство) на юго-западе Великобритании, в графстве Глостершир, на р. Вейсман Август Вейсман (Weismann) Август (17.1.1834, Франкфурт-на-Майне, — 5. |
|